Arzneimittelallergien bei Kindern: was sollten Kinderärzte wissen?
Einleitung
Das Label einer Arzneimittelallergie (AA) haben viele Kinder und dieses kann lebenslange Konsequenzen für den Patienten, aber auch für die gesamte Bevölkerung haben: eingeschränkte Auswahl an Medikamenten und daher weniger effiziente Therapien, Resistenzentwicklung und höhere Gesundheitskosten. Die meisten Kinder tolerieren aber das betroffene Medikament, wenn sie erneut im oralen Provokationstest (OPT) exponiert werden, sind also nicht allergisch. Genaue Studien zur Epidemiologie von AA bei Kindern fehlen und meistens bleibt der OPT das einzige diagnostische Hilfsmittel bei Kindern mit kutanen, nicht gravierenden Reaktionen. Die europäische Gesellschaft für Allergologie und klinische Immunologie (EAACI) hat in den letzten Jahren für die häufigsten Hypersensitivitätsreaktionen bei Kindern, d.h. auf Betalaktam (BL)-Antibiotika, Nicht-steroidale Antirheumatika (NSAR), Antiepileptika und Impfungen, Empfehlungen für die Diagnostik veröffentlicht, welche wir in dieser Übersicht besprechen möchten.
Definition und Klassifikation
Eine Arzneimittelnebenwirkung (ANW) wurde durch die WHO wie folgt definiert: eine schädliche und unbeabsichtigte Reaktion auf ein Arzneimittel (AM), die bei Dosen auftritt, die normalerweise beim Menschen zur Prophylaxe, Diagnose oder Therapie von Krankheiten oder zur Veränderung der physiologischen Funktion verwendet werden1).
ANW werden im Allgemeinen in 2 Typen eingeteilt, Typ-A und Typ-B Reaktionen (siehe Abbildung 1). Typ-A Reaktionen sind Dosis-abhängig und sind vorhersehbare Konsequenzen einer bekannten pharmakologischen Wirkung des Medikaments, wie z.B. Diarrhoe bei Therapie mit Co-Amoxicillin. Etwa 80% der Reaktionen fallen unter diese Kategorie. Typ-B Reaktionen sind weniger häufig, sind unabhängig von der Dosis, nicht vorhersehbar und nicht durch die pharmakologische Wirkung des Medikaments erklärbar2). Zu den Typ-B Reaktionen gehören Arzneimitelhypersensitivitäten und – allergien.

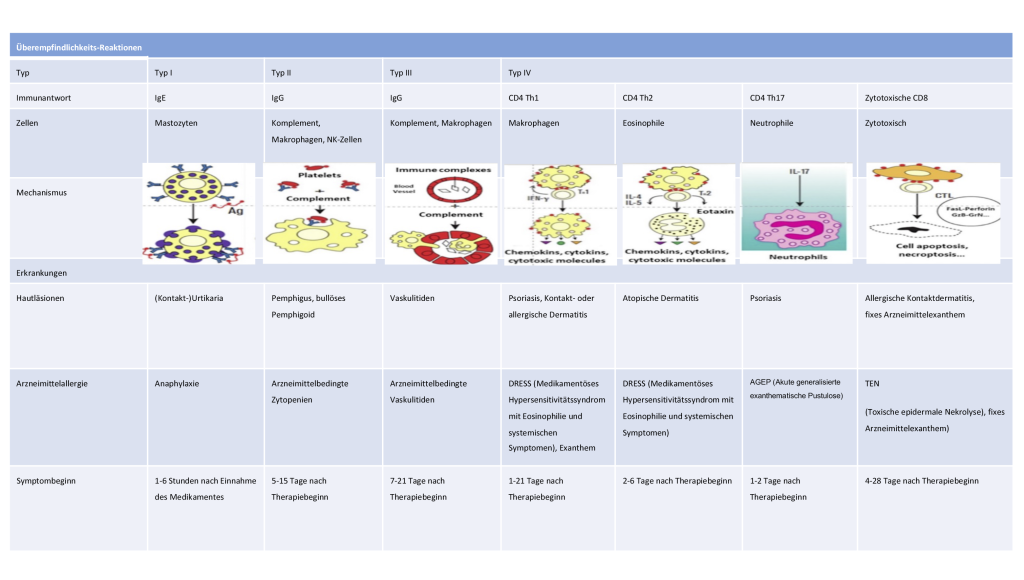
Arzneimittelhypersensitivitäten (AH) können Allergien klinisch sehr ähnlich sein, die Pathogenese ist hier meist nicht klar. Bei AA hingegen sind definierte immunologische Reaktionen beschrieben. Besteht der Verdacht auf eine AA, sollte zunächst von einer Hypersensitivität gesprochen werden, bis eine allergologische Abklärung stattgefunden hat. Klinisch werden immediate, also Reaktionen, die innerhalb von den ersten 1-6 Stunden nach der Einnahme des Medikaments auftreten, von nicht-immediaten Reaktionen unterschieden, welche jederzeit nach der ersten Stunde nach initialer Einnahme auftreten können. Arzneimittelallergien werden nach Gells und Coombs kategorisiert in Typ-I (Arzneimittel-spezifische IgE Antikörper), Typ-II (cytotoxische Reaktion durch Arzneimittel-spezifische IgG Antikörper), Typ-III (Reaktionen durch Immunkomplexe) und Typ-IV (Spättypreaktionen vermittelt durch zelluläre Abwehr) (siehe Abbildung 2).
Epidemiologie
Epidemiologische Untersuchungen für ANW, AH und AA sind selten und unterscheiden meist nicht zwischen Typ-A und Typ-B Reaktionen. Die Prävalenz von selbst berichteten ANW ist bei Kindern seltener als bei Erwachsenen, zwischen 2,9 bis 16,8%3-5).
Nach diagnostischer Beurteilung ist der Anteil von bestätigten AA z.B. bei Betalaktam-Antibiotika bei 0,11-4%6-8). Die häufigsten auslösenden Medikamente, welche ANW hervorrufen, spiegeln auch die am häufigsten verwendeten Medikamente in der Pädiatrie wieder: Antibiotika (v.a. Amoxicillin), NSAR (v.a. Ibuprofen und auch Paracetamol, ein schwacher Cox-1 Hemmer) Antiepileptika und Impfungen.
Klinische Erscheinungsbilder
Bei AH bei Kindern ist die Haut am häufigsten betroffen, aber auch der Gastrointestinaltrakt6, 7, 9-13).
Am häufigsten kommt es auf der Haut zu einem makulopapulösen Exanthem, aber auch zu Urtikaria, Angioödem bzw. fixen Arzneimittelexanthemen13-15). Zu den gastrointestinalen Symptomen gehören Nausea, Erbrechen, Diarrhoe oder Obstipation. Isolierte respiratorische Symptome zeigen sich vor allem bei Anwendung von NSAR, können aber auch Teil einer anaphylaktischen Reaktion sein, welche aber insgesamt selten sind. In der Literatur wird beschreiben, dass etwa 5-25% der Anaphylaxien durch AA hervorgerufen werden. Anaphylaxien durch AA sind häufiger bei älteren Kindern und vor allem NSAR sind die dafür verantwortlichen Medikamente16, 17). Andere Symptome sind Kopfschmerzen, Lethargie, Husten, Palpitationen und Arthritis (siehe Tabelle 2).

Schwere kutane Nebenwirkungen vom Spättyp sind potentiell lebensgefährliche Reaktionen, wie die akute generalisierte exanthematische Pustulose (AGEP), Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), Stevens-Johnson Syndrom (SJS) und toxische epidermale Nekrolyse (TEN)18-20). Eine HLA Assoziation wurde in einer iranischen Bevölkerung beschrieben, vor allem HLA-A*02:01, HLA-A*24:02 und HLA-A*51.01 zeigten ein erhöhtes Risiko für schwere kutane Nebenwirkungen19). Die klinische Präsentation kann sehr variabel sein, die Pathogenese ist nicht klar, man vermutet eine Aktivierung von zytotoxischen T-Zellen. Bei den meisten dieser Krankheitsbilder besteht eine längere Latenzzeit zwischen Einnahme der Medikation und dem Auftreten der Symptome: für DRESS etwa 3 Wochen, für SJS/TEN zwischen 4-6 Tage. Das Ausmass der kutanen Beteiligung ist am grössten beim DRESS ohne Schleimhautbeteiligung, die Abheilung findet ohne Vernarbung statt. Bei SJS- und TEN-Patienten ist meist eine geringere Oberfläche betroffen (bis zu 30% der Körperoberfläche bei TEN), meist sind aber die Schleimhäute involviert. Therapieansätze sind allein unterstützend, das auslösende Medikament muss rasch abgesetzt werden und eine entzündungshemmende Therapie mit z.B. Steroiden begonnen werden.
Häufigste Medikamente
Die häufigsten Ursachen für AH bei Kindern sind Betalaktam-Antibiotika, NSAR und Impfungen.
Im nächsten Abschnitt werden 3 Gruppen der häufigsten Medikamente einzeln behandelt, auch werden wir auf das aktuelle Thema der Reaktionen bei COVID-Impfungen eingehen.
Betalaktam Antibiotika
Die BL-Antibiotika bestehen aus zwei Hauptklassen: Penicilline und Cephalosporine. Sie haben die Besonderheit, dass sie in ihrer Molekularstruktur einen Betalaktamring besitzen, der für ihre antimikrobielle Wirkung verantwortlich ist. An diesem Ring sind Seitenketten angeordnet, welche die Hauptursache für allergische Reaktionen sind.
Sie gehören zu den am häufigsten verschriebenen Antibiotika in der Pädiatrie, insbesondere Amoxicillin, auf das etwa 2/3 der ambulanten Verschreibungen entfallen21). Aufgrund ihrer häufigen Anwendung sind sie auch für die höchste Prävalenz von AH in dieser Bevölkerungsgruppe verantwortlich. In der ambulanten Pädiatrie schwankt die selbst berichtete Prävalenz von Allergien gegen BL-Antibiotika bei Kindern zwischen 1,7 bis 5,2%, wobei Amoxicillin der häufigste Auslöser darstellt22). Die Häufigkeit von nachgewiesenen Allergien ist jedoch deutlich geringer, mit einer geschätzten Prävalenz von etwa 0,11 bis 4%6-8). Viele Kinder, die fälschlicherweise als allergisch eingestuft werden, sind daher unnötigen und manchmal schädlichen Medikamentenausschlüssen ausgesetzt, was die Bedeutung einer gründlichen allergologischen Untersuchung bei Verdacht auf eine AH unterstreicht.
Die klinische Präsentation von AH auf BL-Antibiotika ist sehr unterschiedlich und kann von einem spät auftretenden makulopapulösen Exanthem oder Urtikaria bis hin zu lebensbedrohlichen Manifestationen wie Anaphylaxie oder schweren kutanen Nebenwirkungen vom Spättyp (schwere Toxidermie) reichen. Die meisten Reaktionen bleiben jedoch harmlos und beschränken sich auf einen isolierten Hautausschlag (siehe Tabelle 1).

Die Diagnose basiert auf denselben Grundsätzen wie bei Erwachsenen. Sie beginnt immer mit einer ausführlichen Anamnese, der Durchführung eines Hauttests oder In-vitro-Tests (falls verfügbar) und einem oralen Provokationstest, wenn dieser für eine endgültige Diagnose angezeigt ist (siehe Abbildung 3).
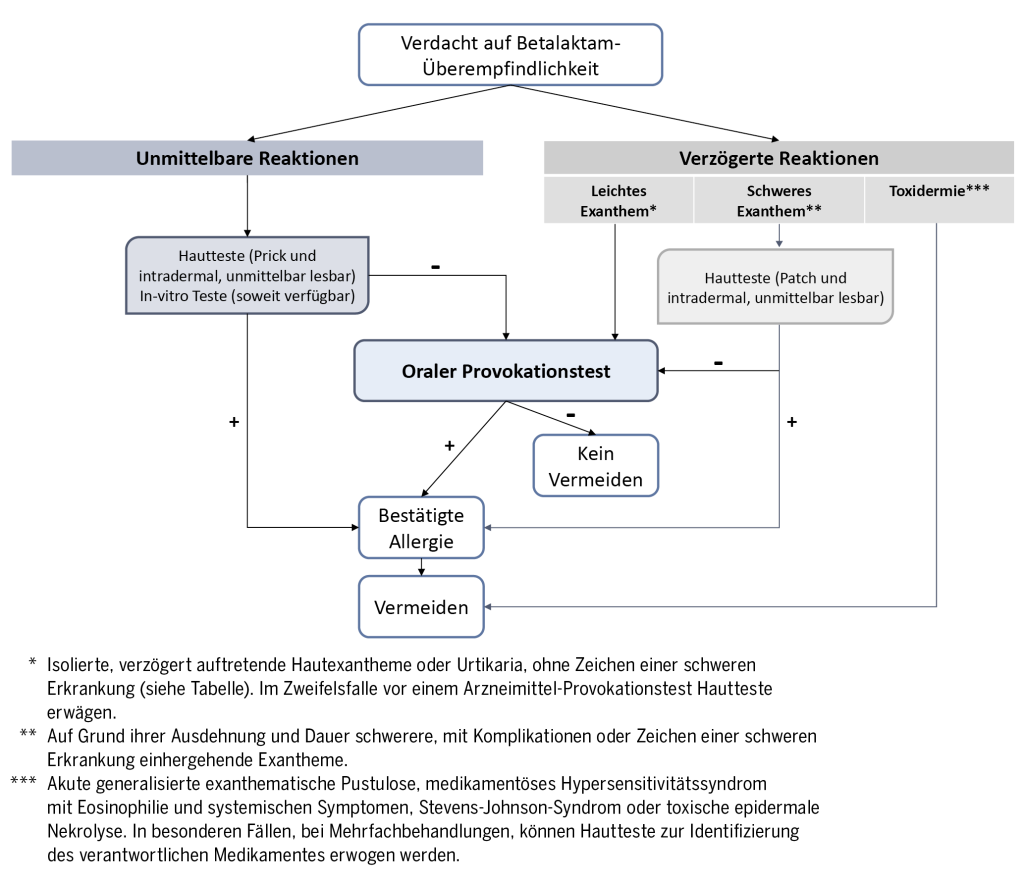
In der Praxis gibt es jedoch einige pädiatrische Besonderheiten: Risikofaktoren, Komorbiditäten und Differenzialdiagnosen sind je nach Alter sehr unterschiedlich. Virale und bakterielle Infektionen mit Exanthemen, die wichtigsten Differentialdiagnosen für AH, sind bei jüngeren Kindern viel häufiger. Außerdem sind Hauttests, insbesondere Intradermal-Tests (IDT), bei Kindern schmerzhaft und schwieriger durchzuführen.
Bei der diagnostischen Beurteilung muss zwischen Sofortreaktionen, die innerhalb einer Stunde nach der letzten Einnahme auftreten, und verzögerten Reaktionen, deren Auftreten zwischen einer Stunde und mehreren Tagen schwankt, unterschieden werden (max. 72h).
Soforttypreaktionen
Reaktionen vom Soforttyp auf BL-Antibiotika sind bei Kindern selten16). Ihre Diagnose beruht im Wesentlichen auf der Durchführung sofort ablesbarer Hauttests (IDT). Bei negativem Befund ist ein oraler Provokationstest (OPT) unter medizinischer Überwachung der Goldstandard für eine endgültige Diagnose. Bei einer schweren Reaktion oder bei Kontraindikationen für Hauttests, kann eine In-vitro-Bestimmung durch Bestimmung des spezifischen IgE23) oder durch einen Basophilen-Aktivierungstest24) einen Zwischenschritt darstellen und so die Verwendung von OPTs einschränken25).
Spättypreaktionen
Nicht-IgE vermittelte Reaktionen auf BL-Antibiotika präsentieren sich sehr häufig als ein makulopapulöses Exanthem oder eine Urtikaria, welche verzögert auftritt. Bestehen keine Symptome einer schweren allergischen Reaktion, schwere kutane Beteiligung oder weitere Hinweise für eine schwerwiegende Reaktion wie z.B. Fieber oder Arthritis, ist eine direkte Diagnostik mittels OPT möglich, ohne dass eine vorherige Hautuntersuchung durchgeführt werden muss. Es wurden verschiedene Provokationsprotokolle mit einer Expositionszeit von 1 bis 10 Tagen vorgeschlagen, ohne dass ein Konsens über das optimale Protokoll erzielt wurde. Angesichts der Tatsache, dass die Dauer des Provokationsprotokolls keinen signifikanten Einfluss auf seinen negativen Vorhersagewert hat, scheint ein Provokationstest mit einer einzigen Dosis für die Diagnose einer BL-Allergie bei Kindern ausreichend zu sein und ermöglicht eine kürzere Expositionszeit mit Antibiotika26).
Bei schwereren Reaktionen ist weiterhin eine Hautuntersuchung (Prick- und IDT) erforderlich, wobei die Ablesung auf 48-72 Stunden verschoben wird. Der Provokationstest wird dann nur bei negativem Hautbefund durchgeführt.
Wenn die Vorgeschichte mit einer schweren Toxidermie vereinbar ist, führt dies in der Regel zu einem strikten Medikamentenverzicht. Bestehen Unklarheiten in Bezug auf die Diagnose, kann in seltenen Fällen dennoch eine Hauttestung durchgeführt werden.
Natürlicher Verlauf der BL-Allergie
Einige Daten legen nahe, dass die Mehrheit der Kinder mit einer bestätigten Allergie gegen BL-Antibiotika nach drei Jahren eine Toleranz entwickelt27). Es sind jedoch weitere Studien erforderlich, um diese Ergebnisse, die auf einer begrenzten Anzahl von Patienten beruhen, zu bestätigen.
Nicht-steroidale Antirheumatika
Die Verwendung von NSAR ist bei Kindern weit verbreitet in der Therapie von Schmerzen, Fieber und als Entzündungshemmer28-30).
Die Prävalenz von AH auf NSAR liegt bei 0,6-5,7% in der Gesamtbevölkerung, bei Kindern wird diese auf ca. 0,5% geschätzt31). Auch scheinen NSAR häufiger für schwere Reaktionen verantwortlich zu sein16, 32, 33).
AH auf NSAR werden meistens in 2 grosse Gruppen eingeteilt, je nachdem, um welche Symptome es sich handelt und ob Kreuzreaktionen vorliegen. Ausserdem spielt der Mechanismus der Reaktion, das Timing und die zu Grunde liegenden Erkrankung in der Einteilung eine Rolle (siehe Abbildung 4). Gemäss den Empfehlungen der EAACI von 2018 kommt es bei Kindern unter 10 Jahren vor allem zu nicht-immunologisch vermittelten Reaktionen mit hoher Kreuzreaktivität (d.h. mehrere Cox-1 Hemmer sind betroffen) und die Reaktionen sind häufig durch Kofaktoren wie sportliche Aktivität, Infektionen oder Lebensmittel verstärkt34). Bei Kindern, welche älter als 10 Jahre sind, scheinen die Reaktionen denen von Erwachsenen ähnlich zu sein. OPTs sind der Goldstandard, um die Diagnose einer NSAR-AH bei Kindern zu sichern. Für eine gute Betreuung von Kinder mit NSAR-AH , benötigen wir eine bestätigte Diagnose und klare Klassifikationen sowie auch Alternativmedikationen. Nachdem es sich bei Kindern unter 10 Jahren meistens um kreuzreaktive Formen handelt, benötigt es auch Provokationstestungen mit NSAR Alternativen. Schwache Cox-1 Hemmer werden häufig vertragen und selektive Cox-2 Hemmer, wie Celecoxib, können ab einem Körpergewicht von 25 Kg verwendet werden, auch wenn sie in dieser Altersgruppe nicht zugelassen sind.

Impfungen
Impfungen sind eines der effizientesten und kostengünstigsten medizinisches Mittel um infektiöse Krankheiten vorzugbeugen. ANW können auch bei Impfungen in allergische (sowohl IgE als auch nicht-IgE vermittelt) und nicht-allergische Reaktionen eingeteilt werden, letztere treten häufig auf und umfassen vor allem Fieber und lokale Schmerzen35). Allergische Reaktionen nach Impfungen sind selten und das Risiko einer Anaphylaxie nach einer Impfung wird auf 1.31 pro 1 Mio. Impfdosen geschätzt36). AH auf Impfstoffe können IgE und nicht-IgE vermittelt sein. Mögliche Allergene sind häufig Zusatzstoffe oder Stoffe, welche durch Kontamination im Rahmen der Produktion in den Impfstoff gelangen. Seltener sind mikrobielle Antigene die Ursache für eine Reaktion. Kontakt mit Desinfektionsmittel vor Impfung, Latex z.B. im Ampullenstopfen , Konservierungsstoffe, wie Formaldehyd oder Stabilisatoren wie Gelatine oder Polysorbat, können zu Soforttypreaktionen aber auch zu allergischen Kontaktdermatitis führen37).
Das häufigste, durch den Produktionsprozess enthaltene Allergen, ist Hühnereiprotein, welches für Patienten mit Hühnereiproteinallergie ein Risiko darstellen kann. Impfstoffe für Masern-Mumps-Röteln (MMR), Tollwut, FSME (hergestellt in Zellkulturen von Hühnerfibroblasten) und Impfstoffe für Grippe (hergestellt in bebrüteten Hühnereiern) enthalten kleinste Mengen an Hühnereiprotein. Patienten mit Hühnereiproteinallergie konnten komplikationslos mit diesen Impfstoffen geimpft werden und dies stellt keine Kontraindikation für die Impfung dar38, 39). Grössere Mengen an Hühnereiprotein können in Gelbfieber-Impfstoffen enthalten sein (0.13-0.61ug/ml, hergestellt in bebrüteten Hühnereiern). Eine fraktionierte Impfung (10%/90%) stellt eine sichere Methode dar, diesen Patienten einen solchen Impfstoff zu verabreichen40). Allergische Reaktionen nach Impfungen können sich als starke Lokalreaktion, Soforttypreaktion (≤4 Stunden) oder Spättypreaktion präsentieren. Starke Lokalreaktionen, leichtgradige Soforttypreaktionen (Grad I) oder Spättypreaktionen stellen keine Kontraindikation für weitere Impfungen dar. Bei Patienten mit höhergradigen Soforttypreaktionen (Grad II-IV) sind Abklärungen durch erfahrene Allergologen/innen indiziert. Eine Abklärung sollte auch bei leichtgradigen Soforttypreaktionen (Grad I) diskutiert werden. Hierzu gehört die Hauttestung des Impfstoffs, Hauttestungen und ggf. spezifische IgE (sIgE) Bestimmungen von Zusatzstoffen (Gelatine, Latex, Chlorhexidin, Ovalbumin) sowie die Bestimmung der Impf-Antikörper. Bei Indikation für eine weitere Impfung kann eine fraktionierte Impfung (in 2-6 Schritten) unter Überwachung und Verfügung einer entsprechenden Notfallversorgung durchgeführt werden41).
Weiter besteht die Besorgnis, dass Impfungen Allergien auslösen. Verschiedene Studien haben sich mit dieser Hypothese auseinandergesetzt und Ankermann et al. fassen diese übersichtlich zusammen. Es besteht keine Evidenz, dass Impfungen atopische Dermatitis, allergische Rhinokonjunktivitis oder Asthma auslösen. Kinder mit Atopie dürfen gleich wie Kinder ohne Atopie geimpft werden37).
Aktuelles Thema: Impfreaktionen auf SARS-Cov2 mRNA Impfstoffe
In der Pandemiebekämpfung sind Covid-19 mRNA Impfstoffe ein wichtiger medizinischer Meilenstein. Bei Erwachsenen traten bei bis zu 2,2% allergische Reaktionen nach der Injektion der ersten Impfdosis mit einem mRNA-Impfstoff auf, schwere allergische Reaktionen waren jedoch sehr selten42).
Seit Januar 2022 ist der Impfoff BNT162b2 Covid-19 (Comirnaty von BioNTech/Pfizer) in der Schweiz bei Kindern von 5-11 Jahren zugelassen. In der Sicherheitsstudie traten keine schweren allergischen Reaktionen auf. Von insgesamt 2268 Patienten entwickelten 4 Patienten ein Exanthem, welches möglicherweise durch die Impfung verursacht wurde.
Als mögliche immunologische Mechanismen werden IgE vermittelte Reaktionen auf Inhaltstoffe wie z.B. Polyethylenglykol (PEG), nicht-IgE vermittelte Reaktionen auf PEG oder durch Lipid-Nanopartikel (LNP)- oder Komplement-vermittelte Mastzellaktivierung diskutiert43).
Schwere allergische Reaktionen stellen aktuell eine Kontraindikation für weitere Impfungen mit einem mRNA-Impfstoff dar, jedoch sind weitere Impfungen für den Schutz vor COVID essentiell. Entsprechend dem Vorgehen bei Hühnereiproteinallergie oder schweren allergischen Reaktionen nach anderen Impfungen sollen Patienten mit allergischer Reaktion Grad II-IV nach einer Covid-19 mRNA Impfung allergologisch abgeklärt werden. Eine sichere Impfung mit fraktionierter Injektion (in 2-5 Schritten) war bei Erwachsenen möglich42-45). Ein entsprechendes Vorgehen ist bei Kindern sinnvoll.
Diagnostik bei Reaktionen auf Arzneimittel
Die Diagnose einer AH erfolgt auf Basis einer detaillierten Anamnese und dem entsprechenden diagnostischen Work-up.
Anamnese
Eine detaillierte Krankengeschichte ist unser wichtigstes Hilfsmittel bei der Diagnose einer AH. Die Anamnese basiert meistens auf den Aussagen von Eltern bzw. Betreuern, welche manchmal subjektive bzw. auch übertriebene Beschreibungen abgeben14). Ein weiteres Problem ist meistens der lange Abstand zwischen der Reaktion und der allergologischen Abklärung, was zu zusätzlichen Ungenauigkeiten in der Krankengeschichte führt. Folgende Informationen sind für die Evaluierung einer AH wichtig:
- Exakter Name, Marke, Dosierung, Anzahl Verabreichungen des Medikaments
- Zeitlicher Zusammenhang zwischen Einnahme des Medikaments und Auftreten der Symptome
- Art der Symptome inklusive Fotodokumentation bei Hauterscheinungen
- Gravierende Reaktionen: Schleimhautbeteiligung, Abheilung mit Narben, Abschuppung, Fieber, Arthritis
- Dauer der Symptome
- Welche weiteren Therapien wurden verabreicht und toleriert nach der Reaktion
- Kam es zu ähnlichen Symptomen auch ohne Einnahme des Medikaments
- Zu Grunde liegende Erkrankungen
- Komedikation
Besteht der Verdacht einer AH, sollte das allergologische Work-up etwa 4-6 Wochen nach kompletter Regredienz der Symptome durchgeführt werden.
Hauttestungen
Zu den Hauttestungen bei AH zählen Haut Prick Tests (PT), intradermale Tests (IDT) und Patch Tests14). PT und IDT können mit guter Sicherheit IgE vermittelte Reaktionen beim Erwachsenen und Jugendlichen diagnostizieren, aber der diagnostische Wert bei Kindern mit verdacht auf eine BL-Allergie wurde in diversen Studien als stark limitiert beurteilt mit einer Sensibilität von etwa 50% und einem positiven prädiktiven Wert von 36%13, 46-49). Spätablesungen der IDT (nach 48-72h) und das Durchführen von Patch Tests können helfen, Spättypreaktionen und schwere kutane ANW zu identifizieren. Dennoch ist ein negativer Hauttest nach den heutigen Empfehlungen nicht der Goldstandard um AH bei Kindern auszuschliessen13, 47, 50). Aufgrund der Schmerzen und der Schwierigkeit der Durchführung von IDT sowie der geringen Sensibilität, wird heute vor allem bei unkomplizierten Spättypreaktionen auf Hauttestungen verzichtet und ein OPT durchgeführt14, 51).
In Vitro Test
Der einzige kommerziell verfügbare Test für AH sind sIgE Messungen (ImmunoCAP, ThermoFisher, Uppsala, Schweden), welche aber nur für einige wenige Arzneimittel zur Verfügung stehen, wie z.B. für Amoxicillin, Cefaclor, Penicillin G und V. Diese können eventuell bei IgE vermittelten Soforttypreaktionen hilfreich sein, wenn Patienten verschiedene Medikamente eingenommen haben oder wenn aufgrund von schweren Reaktionen die Durchführung von Hauttestungen kontraindiziert ist. Bei Erwachsenen gibt es die Möglichkeit der Durchführung eines Basophilen Aktivierungstests (BAT). Jedoch haben der sIgE und auch der BAT eine geringe Sensitivität (0-50% für sIgE, 22-55% für BAT bei BL- Antibiotika), kombiniert mit einer hohen Spezifizität25). Lymphozytentransformationstest (LTT) können ein weiteres diagnostisches Hilfsmittel sein. Beim Erwachsenen zeigt sich eine hohe Spezifizität und eine hohe Sensibilität von 58-88%. Der Zeitpunkt der Durchführung des LTT wird diskutiert, es zeigt sich eine höhere Sensitivität in den ersten Wochen nach der Reaktion (max. 3 Monate nach der Reaktion)52). Der LTT hat jedoch die Limitation, dass hier etwa 50ml Blut notwendig sind und der Test nicht unter Steroidtherapie durchgeführt werden kann.
Orale Provokationstestungen
OPTs sind bei leichten, meist kutanen Reaktionen der heutige Goldstandard, um eine AH zu bestätigen oder auszuschliessen. Diese sollten in einem Zentrum bzw. bei Allergologen/Allergologinnen durchgeführt werden, welches/welcher Erfahrung in der Beurteilung solcher Provokationstestungen haben. Verschiedene Protokolle wurden für Kinder vorgeschlagen: einmalige Dosis, aufsteigende Dosen oder auch Provokationstestungen über mehrere Tage. Bis heute gibt es keine standardisierten Protokolle. Die EAACI schlägt folgendes Protokoll vor: 1. Dosis 10% einer Einmaldosis (adaptiert an Gewicht und Alter), gefolgt von 50% und 100%14). Bei schweren Reaktionen kann die 1. Dosis auch geringer sein, zwischen 1:1000 und 1:10.000. Kontraindikationen für die Provokationstestungen sind akute Infektionen, unkontrolliertes Asthma oder Grunderkrankungen, welche zu stärkeren Reaktionen führen können bzw. zu schweren lebensbedrohliche Reaktionen (Anaphylaxie, bzw. schwere kutane NW). Provokationstestungen sollten unter medizinischer Überwachung mit erfahrenem Personal durchgeführt werden.
Zusammenfassung
Arzneimittehyperreaktivitäten werden in der Pädiatrie häufig vermutet, aber selten bestätigt. Die häufigsten auslösenden Medikamente sind Betalaktam-Antibiotika, nichtsteroidale Antirheumatika sowie Impfstoffe. Die Diagnose einer Arzneimittelallergie wird zu häufig gestellt, hauptsächlich aus Angst vor einer schweren anaphylaktischen Reaktion. Die meisten betroffenen Kinder könnten jedoch ohne erhöhtes Risiko einer unerwünschten Reaktion erneut dem betroffenen Medikament ausgesetzt werden. Eine vollständige allergologische Untersuchung sollte daher innerhalb eines angemessenen Zeitraums durchgeführt werden, um unnötiges und oft schädliches Vermeiden von Medikamenten zu verhindern.
Referenzen
- International drug monitoring: the role of national centres. Report of a WHO meeting. World Health Organ Tech Rep Ser. 1972:498:1-25.
- Edwards IR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and management. Lancet. 2000;356(9237):1255-9.
- Impicciatore P, Choonara I, Clarkson A, Provasi D, Pandolfini C, Bonati M. Incidence of adverse drug reactions in paediatric in/out-patients: a systematic review and meta-analysis of prospective studies. Br J Clin Pharmacol. 2001;52(1):77-83.
- Smyth RM, Gargon E, Kirkham J, Cresswell L, Golder S, Smyth R, et al. Adverse drug reactions in children–a systematic review. PLoS One. 2012;7(3):e24061.
- Vyles D, Chiu A, Simpson P, Nimmer M, Adams J, Brousseau DC. Parent-Reported Penicillin Allergy Symptoms in the Pediatric Emergency Department. Acad Pediatr. 2017;17(3):251-5.
- Erkocoglu M, Kaya A, Civelek E, Ozcan C, Cakir B, Akan A, et al. Prevalence of confirmed immediate type drug hypersensitivity reactions among school children. Pediatr Allergy Immunol. 2013;24(2):160-7.
- Rebelo Gomes E, Fonseca J, Araujo L, Demoly P. Drug allergy claims in children: from self-reporting to confirmed diagnosis. Clin Exp Allergy. 2008;38(1):191-8.
- Vezir E, Dibek Misirlioglu E, Civelek E, Capanoglu M, Guvenir H, Ginis T, et al. Direct oral provocation tests in non-immediate mild cutaneous reactions related to beta-lactam antibiotics. Pediatr Allergy Immunol. 2016;27(1):50-4.
- Bergmann M, Caubet JC. Specific Aspects of Drug Hypersensitivity in Children. Curr Pharm Des. 2016;22(45):6832-51.
- Gamboa PM. The epidemiology of drug allergy-related consultations in Spanish Allergology services: Alergologica-2005. J Investig Allergol Clin Immunol. 2009;19 Suppl 2:45-50.
- Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol. 2005;5(4):309-16.
- Lange L, Koningsbruggen SV, Rietschel E. Questionnaire-based survey of lifetime-prevalence and character of allergic drug reactions in German children. Pediatr Allergy Immunol. 2008;19(7):634-8.
- Rukasin CRF, Norton AE, Broyles AD. Pediatric Drug Hypersensitivity. Curr Allergy Asthma Rep. 2019;19(2):11.
- Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca-Lopez N, et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016;71(2):149-61.
- Kim B, Kim SZ, Lee J, Jung AH, Jung SH, Hahn HJ, et al. Clinical profiles of adverse drug reactions spontaneously reported at a single Korean hospital dedicated to children with complex chronic conditions. PLoS One. 2017;12(2):e0172425.
- Grabenhenrich LB, Dolle S, Moneret-Vautrin A, Kohli A, Lange L, Spindler T, et al. Anaphylaxis in children and adolescents: The European Anaphylaxis Registry. J Allergy Clin Immunol. 2016;137(4):1128-37 e1.
- Lee SY, Ahn K, Kim J, Jang GC, Min TK, Yang HJ, et al. A Multicenter Retrospective Case Study of Anaphylaxis Triggers by Age in Korean Children. Allergy Asthma Immunol Res. 2016;8(6):535-40.
- Duong TA, Valeyrie-Allanore L, Wolkenstein P, Chosidow O. Severe cutaneous adverse reactions to drugs. Lancet. 2017;390(10106):1996-2011.
- Esmaeilzadeh H, Farjadian S, Alyasin S, Nemati H, Nabavizadeh H, Esmaeilzadeh E. Epidemiology of Severe Cutaneous Adverse Drug Reaction and Its HLA Association among Pediatrics. Iran J Pharm Res. 2019;18(1):506-22.
- Oh HL, Kang DY, Kang HR, Kim S, Koh YI, Kim SH, et al. Severe Cutaneous Adverse Reactions in Korean Pediatric Patients: A Study From the Korea SCAR Registry. Allergy Asthma Immunol Res. 2019;11(2):241-53.
- Sellam A, Chahwakilian P, Cohen R, Bechet S, Vie Le Sage F, Levy C. [Impact of guidelines on ambulatory pediatric antibiotic prescriptions]. Arch Pediatr. 2015;22(6):595-601.
- Mirakian R, Leech SC, Krishna MT, Richter AG, Huber PA, Farooque S, et al. Management of allergy to penicillins and other beta-lactams. Clin Exp Allergy. 2015;45(2):300-27.
- Ebo DG, Leysen J, Mayorga C, Rozieres A, Knol EF, Terreehorst I. The in vitro diagnosis of drug allergy: status and perspectives. Allergy. 2011;66(10):1275-86.
- Ariza A, Montanez MI, Fernandez TD, Perkins JR, Mayorga C. Cellular Tests for the Evaluation of Drug Hypersensitivity. Curr Pharm Des. 2016;22(45):6773-83.
- Mayorga C, Celik G, Rouzaire P, Whitaker P, Bonadonna P, Rodrigues-Cernadas J, et al. In vitro tests for drug hypersensitivity reactions: an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2016;71(8):1103-34.
- Graham F, Tsabouri S, Caubet JC. Hypersensitivity reactions to beta-lactams in children. Curr Opin Allergy Clin Immunol. 2018;18(4):284-90.
- Tonson la Tour A, Michelet M, Eigenmann PA, Caubet JC. Natural History of Benign Nonimmediate Allergy to Beta-Lactams in Children: A Prospective Study in Retreated Patients After a Positive and a Negative Provocation Test. J Allergy Clin Immunol Pract. 2018;6(4):1321-6.
- Eustace N, O’Hare B. Use of nonsteroidal anti-inflammatory drugs in infants. A survey of members of the Association of Paediatric Anaesthetists of Great Britain and Ireland. Paediatr Anaesth. 2007;17(5):464-9.
- Lesko SM, Mitchell AA. The safety of acetaminophen and ibuprofen among children younger than two years old. Pediatrics. 1999;104(4):e39.
- Neubert A, Verhamme K, Murray ML, Picelli G, Hsia Y, Sen FE, et al. The prescribing of analgesics and non-steroidal anti-inflammatory drugs in paediatric primary care in the UK, Italy and the Netherlands. Pharmacol Res. 2010;62(3):243-8.
- Kidon MI, See Y. Adverse drug reactions in Singaporean children. Singapore Med J. 2004;45(12):574-7.
- Gabrielli S, Clarke AE, Eisman H, Morris J, Joseph L, La Vieille S, et al. Disparities in rate, triggers, and management in pediatric and adult cases of suspected drug-induced anaphylaxis in Canada. Immun Inflamm Dis. 2018;6(1):3-12.
- Jares EJ, Baena-Cagnani CE, Sanchez-Borges M, Ensina LF, Arias-Cruz A, Gomez M, et al. Drug-Induced Anaphylaxis in Latin American Countries. J Allergy Clin Immunol Pract. 2015;3(5):780-8.
- Kidon M, Blanca-Lopez N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal anti-inflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018;29(5):469-80.
- Kelso JM, Greenhawt MJ, Li JT, Nicklas RA, Bernstein DI, Blessing-Moore J, et al. Adverse reactions to vaccines practice parameter 2012 update. J Allergy Clin Immunol. 2012;130(1):25-43.
- McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141(2):463-72.
- Ankermann T, Spindler T, Gerstlauer M, Schmidt S. Allergies and vaccination: a myth demystified2018.
- Kelso JM. Allergic reactions after immunization. Ann Allergy Asthma Immunol. 2013;110(6):397-401.
- Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M, Investigators SS. Safety of live attenuated influenza vaccine in atopic children with egg allergy. J Allergy Clin Immunol. 2015;136(2):376-81.
- Sharma K, Perrett KP, Wood N. Yellow Fever Vaccination In EGG-Allergic Children. Pediatr Infect Dis J. 2020;39(6):e76-e8.
- Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, et al. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017;28(7):628-40.
- Blumenthal KG, Robinson LB, Camargo CA, Jr., Shenoy ES, Banerji A, Landman AB, et al. Acute Allergic Reactions to mRNA COVID-19 Vaccines. JAMA. 2021;325(15):1562-5.
- Warren CM, Snow TT, Lee AS, Shah MM, Heider A, Blomkalns A, et al. Assessment of Allergic and Anaphylactic Reactions to mRNA COVID-19 Vaccines With Confirmatory Testing in a US Regional Health System. JAMA Netw Open. 2021;4(9):e2125524.
- Krantz MS, Bruusgaard-Mouritsen MA, Koo G, Phillips EJ, Stone CA, Jr., Garvey LH. Anaphylaxis to the first dose of mRNA SARS-CoV-2 vaccines: Don’t give up on the second dose! Allergy. 2021;76(9):2916-20.
- Tuong LC, Capucilli P, Staicu M, Ramsey A, Walsh EE, Shahzad Mustafa S. Graded Administration of Second Dose of Moderna and Pfizer-BioNTech COVID-19 mRNA Vaccines in Patients With Hypersensitivity to First Dose. Open Forum Infect Dis. 2021;8(12):ofab507.
- Atanaskovic-Markovic M, Gaeta F, Gavrovic-Jankulovic M, Cirkovic Velickovic T, Valluzzi RL, Romano A. Diagnosing multiple drug hypersensitivity in children. Pediatr Allergy Immunol. 2012;23(8):785-91.
- Caubet JC, Kaiser L, Lemaitre B, Fellay B, Gervaix A, Eigenmann PA. The role of penicillin in benign skin rashes in childhood: a prospective study based on drug rechallenge. J Allergy Clin Immunol. 2011;127(1):218-22.
- Ponvert C, Perrin Y, Bados-Albiero A, Le Bourgeois M, Karila C, Delacourt C, et al. Allergy to betalactam antibiotics in children: results of a 20-year study based on clinical history, skin and challenge tests. Pediatr Allergy Immunol. 2011;22(4):411-8.
- Romano A, Gaeta F, Valluzzi RL, Alonzi C, Viola M, Bousquet PJ. Diagnosing hypersensitivity reactions to cephalosporins in children. Pediatrics. 2008;122(3):521-7.
- Saretta F, Mori F, Cardinale F, Liotti L, Franceschini F, Crisafulli G, et al. Pediatric drug hypersensitivity: which diagnostic tests? Acta Biomed. 2019;90(3-S):94-107.
- Confino-Cohen R, Rosman Y, Meir-Shafrir K, Stauber T, Lachover-Roth I, Hershko A, et al. Oral Challenge without Skin Testing Safely Excludes Clinically Significant Delayed-Onset Penicillin Hypersensitivity. J Allergy Clin Immunol Pract. 2017;5(3):669-75.
- Romano A, Atanaskovic-Markovic M, Barbaud A, Bircher AJ, Brockow K, Caubet JC, et al. Towards a more precise diagnosis of hypersensitivity to beta-lactams – an EAACI position paper. Allergy. 2020;75(6):1300-15.
- Park JS, Suh DI. Drug Allergy in Children: What Should We Know? Clin Exp Pediatr. 2020;63(6):203-10.
- P.Villani A, Gamradt P, Nosbaum A, Laoubi L, Jullien D, Nicolas J-F, et al. Immune-mediated skin diseases induced by chemicals and drugs. 2018.
- Bamanikar. A REVIEW OF DRUG ALLERGIES: DIAGNOSIS AND MANAGEMENT. EMJ Allergy Immunol. 2016:1[]:52-7.
Weitere Informationen
Autoren/Autorinnen
-
Dr. med. Felicitas Bellutti EndersAbteilung für Allergologie und klinische Immunologie, UKBB, Universitäts-Kinderspital beider Basel, Basel, Schweiz
-
Dr. med. Michèle RothUnité d’allergologie pédiatrique, UKBB, Hôpital universitaire des enfants, Bâle
-
Dr. med. Samuel RoethlisbergerAllergologue pédiatre, Centre médical Gland, Vaud
