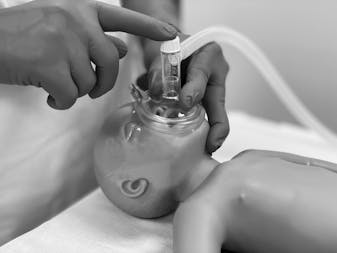
Ein Neugeborenen-Screening auf verschiedene angeborene Stoffwechselkrankheiten besteht in der Schweiz bereits seit über 40 Jahren und wird landläufig auch «Guthrie- Test» genannt. Der Name stammt vom Mikrobiologen Robert Guthrie, der 1960 ein Verfahren zur Diagnose der Phenylketonurie aus einem Bluttropfen entwickelt hat. Beim Neugeborenen-Screening wird am vierten Lebenstag bei jedem Neugeborenen in der Schweiz etwas Blut an der Ferse abgenommen und auf einem Filterpapier getrocknet. Dieses wird seit Herbst 2005 im einzigen Neugeborenen-Screeninglabor der Schweiz, im Kinderspital Zürich, verarbeitet, wo auf sechs behandelbare Krankheiten (Tab. 1) getestet wird. Werden diese Krankheiten nicht behandelt, kommt es in den meisten Fällen zu schweren Organschädigungen und Entwicklungsstörungen.
Neugeborenen-Screening auf zystische Fibrose – bald auch in der Schweiz?