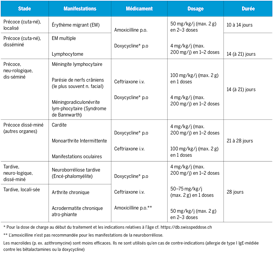
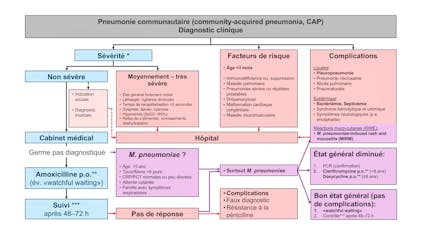
Malgré les progrès en prévention, diagnostic et traitement des infections bactériennes, les infections invasives représentent encore, à l’heure actuelle, une des causes principales de mortalité infantile1), 2). Dans le monde, environ 6 millions d’enfants décèdent annuellement d’une septicémie (http://www.wfpiccs.org/sepsis.php). Ce sont les nourrissons et les petits enfants qui courent, de loin, le plus grand risque de contracter ou même de décéder d’une infection sévère. Bien que, depuis les années 1990, la mortalité pendant l’enfance ait diminué de 10% à environ 5%3), 4), l’incidence de la septicémie a même augmenté globalement. Une étude publiée récemment en Angleterre constate que 15% des décès d’enfants sont dus à une infection5). Le Groupe d’intérêt de la médecine intensive pédiatrique a publié l’année dernière, dans Paediatrica, des recommandations pour le traitement de la septicémie6).
Pourquoi les enfants contractent une septicémie