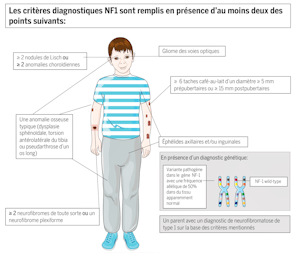
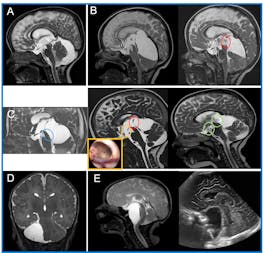
Pour l’enfant, le diagnostic tardif d’une maladie métabolique a souvent pour onséquence des troubles durables du développement psychomoteur. Une prise en charge précoce n’est possible que si le médecin traitant suspecte le trouble du métabolisme. Les mesures thérapeutiques consistent en première ligne à éliminer et à éviter les substances potentiellement toxiques. Pour certaines maladies métaboliques on remplace les substances qui font défaut. Des mesures diététiques et, de plus en plus aussi, des médicaments spécifiques peuvent compléter le traitement. La confirmation génétique du diagnostic permet de conseiller les parents avant une grossesse ultérieure. Nous illustrons dans cet article les approches diagnostiques et thérapeutiques de maladies métaboliques par l’exemple d’une maladie congénitale rare, le syndrome de SmithLemli-Opitz (SLO). Les possibilités de compensation maternelle étant insuffisantes, le syndrome SLO se manifeste déjà pendant la période prénatale. Le suivi p.ex. des mesures diététiques et les adaptations thérapeutiques exigent une prise en charge interdisciplinaire et une relation de confiance solide entre l’équipe soignante et la famille.
Neurométabolisme pour le pédiatre