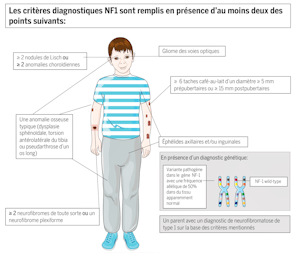
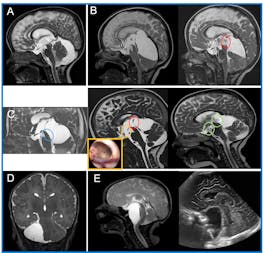
La prise en charge neurochirurgicale des patients pédiatriques en Suisse est en pleine mutation. Traditionnellement effectuée par les collègues chirurgiens pédiatres, une tendance à la sous-spécialisation pédiatrique de spécialistes de la neurochirurgie adulte se dessine ces dernières années. La raison de cette évolution est d’une part la complexité croissante des traitements et une offre toujours plus large de moyens techniques, d’autre part également une adaptation de la Suisse à l’évolution internationale. Nous souhaitons donner dans cet article un aperçu des pathologies neurochirurgicales qui se manifestent typiquement pendant l’enfance – rédigé par des neurochirurgiens résolument intéressés par la pédiatrie et la formation postgraduée pédiatrique. Le choix a été fait en espérant qu’il soit d’intérêt pour la pratique quotidienne du pédiatre praticien.
Neurochirurgie pour le pédiatre