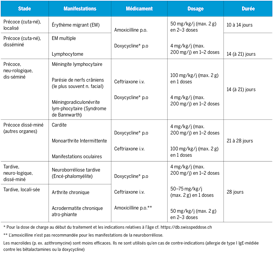
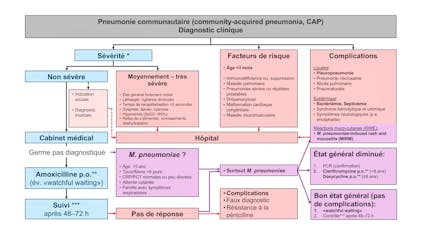
La maladie de Chagas, ou trypanosomiase américaine, est une zoonose endémique en Amérique Latine. Fréquemment asymptomatique, elle est responsable dans sa forme chronique d’atteintes cardiaques et digestives potentiellement mortelles. Elle figure sur la liste des maladies négligées de l’Organisation Mondiale de la Santé (OMS). Si sa transmission est principalement vectorielle, elle peut également être transmise par voie transplacentaire. En Suisse, les cas d’infections congénitales ne sont pas exceptionnels au sein de la population d’origine latino-américaine et sont probablement sous-diagnostiqués en l’absence d’un programme national de dépistage pour la population à risque. Les chances de guérison après traitement sont plus élevées chez le petit enfant, raison pour laquelle le dépistage devrait être effectué le plus précocement possible et les pédiatres familiarisés avec cette pathologie. De plus, un dépistage de la fratrie permet souvent d’identifier d’autres infections silencieuses. Après une présentation générale de la maladie, nous nous focaliserons sur le dépistage et la prise en charge des cas de transmission verticale.
Maladie de Chagas: le point pour le pédiatre