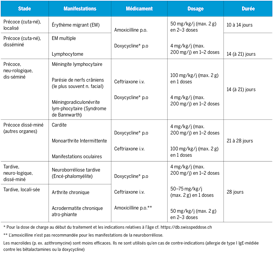
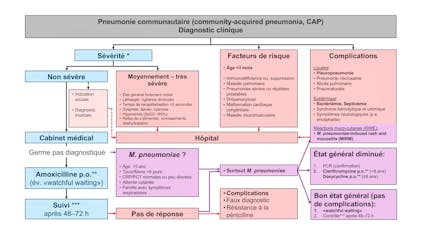
La Suisse s’est fixé, avec d’autres membres de l’Organisation Mondiale de la Santé (OMS), l’objectif d’éradiquer la rougeole en Europe jusqu’en 2015. La transmission devrait être évitée en première ligne par une couverture vaccinale élevée, mais aussi par le diagnostic précoce des cas de rougeole. Afin que la rougeole disparaisse complètement en Suisse, 95 % de la population doit être immunisée contre cette maladie. Cet objectif n’a pas été atteint malgré un taux de vaccination en augmentation. Entre 2011 et 2014 la couverture vaccinale contre la rougeole en Suisse était en moyenne de 86 %, pour 2 doses chez les enfants de 2 ans1). Avec 3 cas par million d’habitants, l’incidence a atteint son niveau le plus bas depuis l’introduction en 1999 de la déclaration obligatoire2). Malgré cette forte diminution de l’incidence, des cas sporadiques sont toujours signalés et attendus en Suisse, aussi longtemps que, selon les estimations de l’Office Fédéral de la Santé Publique (OFSP), > 1 million de doses vaccinales supplémentaires ne soient administrées pour combler les lacunes vaccinales en Suisse3). Le diagnostic précoce des cas de rougeole est primordial afin d’éviter sa transmission. Suite à la diminution de l’incidence, et donc de l’expérience clinique des médecins, la valeur prédictive du diagnostic clinique de rougeole (voir encadré «Définition de cas suspect de rougeole») a nettement diminué4). Il est donc nécessaire de confirmer par une analyse de laboratoire tous les cas n’étant pas en lien épidémiologique avec un cas avéré. Le délai de confirmation en laboratoire ne devrait en aucun cas dépasser les 72 heures. C’est en effet durant cet intervalle que la vaccination post-expositionelle contre la rougeole permet d’éviter la transmission de la maladie aux personnes exposées non vaccinées âgées de plus de 6 mois5). La période de contagiosité s’étend jusqu’à 4 jours après l’apparition de l’exanthème, la confirmation du diagnostic au-delà des 72 premières heures n’est donc pas très utile, ni en termes de traitement individuel ni pour éviter une flambée.
Diagnostic de la rougeole – rôle de la réaction en chaîne par polymérase