Der Einfluss von Atemwegsinfekten, Allergien und Umweltfaktoren auf die Kindergesundheit: Zusammenhänge und präventive Ansätze
Lead
Virale Atemwegsinfektionen im Kindesalter sind häufig und werden durch Umweltfaktoren wie Pollen, Luftverschmutzung und Klimaerwärmung weiter begünstigt. Vorbeugende Massnahmen geraten zunehmend in den Fokus, u.a. die Primär- und Sekundärprävention mit Bakterienlysaten.
Abstract
Atemwegsinfektionen (AWI) im Kindesalter sind meist viral verursacht. Sie treten vor allem im Winter auf, können aber auch ausserhalb der kalten Jahreszeit durch Umweltfaktoren wie Pollen, Luftverschmutzung und Klimaerwärmung begünstigt werden. Neuere Studien haben ergeben, dass eine aerogene Pollenbelastung das Risiko für AWI sowohl mit als auch ohne Allergien in der Vorgeschichte erhöhen können. Daher drängt sich die Frage auf, ob es sinnvoll wäre, bei Risikopatient:innen wie Kindern mit häufigen AWI und Allergien oder Asthma eine ganzjährige Infekt-Prävention durchzuführen. Die Prävention von AWI und die Abmilderung deren Symptome sind wichtige Fragen, die durch den Klimawandel und die Verschlechterung der Luftqualität in Zukunft noch relevanter werden könnten. In diesem Artikel beleuchten wir die Zusammenhänge zwischen AWI, Allergien und Umwelt- bzw. Klimafaktoren und zeigen mögliche Strategien der Prävention im Kindesalter auf.
Einleitung
Menschen mit Asthma und chronisch obstruktiver Lungenerkrankung (COPD) haben ein erhöhtes Risiko, schwerer oder mit prolongierten Symptomen an viralen AWI zu erkranken; gleichzeitig können AWI sowohl COPD-Exazerbationen als auch Asthmaanfälle auslösen(1, 2, 3). Schätzungen zufolge sind respiratorische Viren (insbesondere Influenza, RSV und Rhinoviren) für mehr als 85 % der Asthmaanfälle verantwortlich(4). Kinder haben ein generell erhöhtes Risiko für virale Atemwegsinfektionen und sie sind auch besonders anfällig für die Kombination aus Luftverschmutzung, Inhalationsallergien und respiratorischen Infektionen, die weltweit zu einem zunehmenden Problem wird(5,6). Ebenfalls gehören schwere AWI vor dem Alter von 5 Jahren zu den Faktoren, die dazu beitragen, das COPD-Risiko im späteren Erwachsenenalter zu erhöhen(7, 8).
Infektionen, Umweltfaktoren und die Rolle von Allergien
Umweltfaktoren können die Anfälligkeit für AWI erhöhen. Einige von ihnen, z.B. Luftverschmutzung oder aerogene Allergene (u.a. Kotpartikel der Hausstaubmilben), sind das ganze Jahr über präsent. Daneben ist in diesem Zusammenhang auch die Exposition gegenüber saisonalen Aeroallergenen relevant. Pollen können die Expression von Interferon α, β und λ herunterregulieren, die eine wichtige Rolle in der antiviralen Immunantwort spielen(9, 10). Darüber hinaus wirken Pollen als Vehikel sowohl für Luftschadstoffe als auch für Krankheitserreger, insbesondere Viren(11). Fatalerweise gibt es zwischen Luftverschmutzung und Pollenbelastung einen Zusammenhang aufgrund der Klimaveränderung bzw. -erwärmung, welche einen grossen Einfluss auf die Aerobiologie insbesondere im Hinblick auf Pollen ausübt. Aufgrund der Erderwärmung ist mit einer zeitlich verlängerten Pollensaison (früherer Beginn, längere Dauer) und zusätzlich einer quantitativ verstärkten Pollenproduktion (generell wärmeres Klima, höherer CO2-Anteil in der Atmosphäre, zunehmend Stressphasen für pollenproduzierende Pflanzen mit vermehrtem Anfall von sogenannten Mastjahren) zu rechnen. Zudem wird es aufgrund veränderter Wachstumsbedingungen zu Verschiebungen der pollenproduzierenden Pflanzen in Bezug auf deren Vegetationszonen kommen(12). So wird sich zum Beispiel die Vegetationszone für Ambrosia immer weiter polwärts verschieben; damit wird die Belastung mit einer relevanten Pollenquelle auch in gemässigten Breiten zunehmend an Bedeutung gewinnen.
Klimawandel, Luftverschmutzung und o.g. Veränderungen der Aerobiologie beeinflussen das Auftreten von allergischen Erkrankungen zudem direkt via Einfluss auf die epitheliale Barrierefunktion bzw. deren Disruption, via die T-Helferzell-Typ 2 (Th2)-Antwort bzw. deren Verstärkung, und über epigenetische Mechanismen wie veränderte Methylierungsmuster immunoregulatorischer Gene, u.a. FOXP3, IL4, IL10 und IFNG(12). Zudem enthalten Pollen, ähnlich wie Milbenkot, Proteasen, die die Integrität der Epithelmembran direkt negativ beeinflussen(13). Gerade aber der Einfluss der Luftverschmutzung auf die Integrität der Barrierefunktion der Atemwegsschleimhäute u.a. durch oxidativen Stress, verminderte Expression sogenannter tight junction-Proteine und vermehrter Produktion proinflammatorischer Zytokine erlaubt äusseren Faktoren wie Allergenen, aber auch Viren, einfacher zu infiltrieren und zu Entzündungsreaktionen zu führen(12, 14, 15). Es kann sich in der Folge ein Teufelskreis aus Dysbiosis (Veränderung des lokalen Mikrobioms mit Zunahme der Kolonisierung auch durch opportunistische Erreger), Translokation der Krankheitserreger im Rahmen von AWI in tiefere Gewebsschichten, entsprechender Immunreaktion mit Entzündungsreaktion und beeinträchtigter Abheilung der Mukosaschäden entwickeln(16).
Aufgrund verminderter epithelialer Abwehrfunktionen haben Allergiker:innen zudem schon generell ein erhöhtes Risiko für AWI, was einen weiteren Verstärkungsmechanismus darstellt. Dies zeigt sich v.a. früh im Leben. So weisen Säuglinge, welche später eine Atopie oder gar eine manifeste allergische Erkrankung der Atemwege entwickeln, eine verzögerte Entwicklung und Reifung der Immunantwort auf. Der anfangs bei allen Säuglingen inhärente Bias zu einer Th2-Immunantwort mit verzögerter Entwicklung einer T-Helferzell-Typ 1 (Th1)-Antwort ist bei Vorliegen einer atopischen Prädisposition verstärkt(17). Dies resultiert in einer weniger effizienten Th1-Immunantwort und beispielsweise verminderter Produktion von Interferon-gamma (IFN-γ) im Rahmen der antiviralen Immunantwort bei AWI. Diese Kombination aus einer anfänglich weniger effizienten Th1-Immunantwort und verzögerter Entwicklung einer fokussierten, effizienteren Immunreaktion führt u.a. zu einem verstärkten Auftreten von viralen Atemwegserkrankungen bei Atopiker:innen bzw. Allergiker:innen schon früh im Leben(12). Deshalb können Umweltfaktoren über das ganze Jahr Atemwegsinfektionen begünstigen, und zwar durch Mechanismen, die nicht grundsätzlich mit Atopie oder allergischen Erkrankungen der Atemwege verbunden oder durch diese verursacht sind, aber durch deren Vorhandensein zusätzlich verstärkt werden.
Darüber hinaus zeigen neuere Studien, dass Luftschadstoffe im Rahmen der o.g. Zusammenhänge nicht nur die antivirale Abwehr schwächen, sondern auch selbst die Balance zwischen der TH1- und TH2-Immunantwort verschieben. Dies begünstigt allergische Entzündungen, kann aber gleichzeitig unabhängig von o.g. Faktoren die Fähigkeit zur Virusabwehr beeinträchtigen, da die Produktion von Interferonen (z. B. IFN-γ) reduziert wird(6). Besonders bei Kindern mit viralen Infekten wie RSV oder Rhinovirus wurde eine verstärkte Virusreplikation bei gleichzeitiger epithelialer Barrierestörung und reduzierter Interferonantwort beobachtet, was die Entstehung oder Verschlechterung asthmatischer Symptome begünstigt(2). Frühkindliche virale Infektionen gelten inzwischen als Risikofaktor für die Entwicklung chronischer Atemwegserkrankungen wie Asthma, insbesondere wenn genetische Prädispositionen und Umweltbelastungen wie Luftverschmutzung hinzukommen. Somit wirken Luftverschmutzung und virale Infektionen synergistisch auf die Atemwegsschleimhaut – mit potenziell langfristigen Folgen für die respiratorische Gesundheit.
Synchrone Peaks
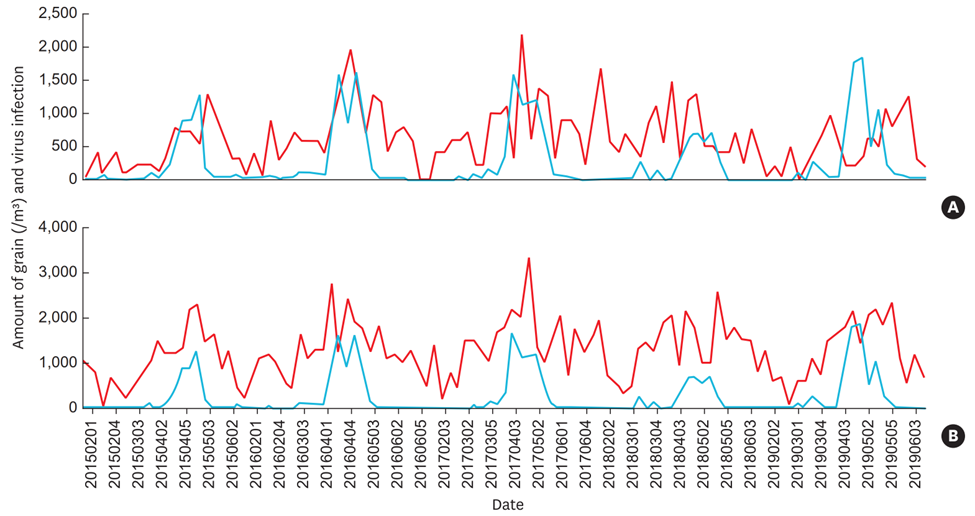
Einer der am besten dokumentierten Fälle, der zu einem Anstieg der AWI im Zusammenhang mit Pollen führte, war die COVID-19-Epidemie. Insbesondere in der Schweiz konnte eine zeitliche Korrelation zwischen SARS-CoV-2 Infektionszahlen und Pollenhöchstwerten, und damit Pollenexposition, festgestellt werden(18). Diese Beobachtung ist jedoch nicht spezifisch für COVID-19. Eine Studie über fünf Jahre zeigte die Synchronizität von Pollenpeaks und AWI bei 6‘223 südkoreanischen Kindern(5), und zwar unabhängig von ihrem allergischen Status (Abb. 1). Der Zusammenhang zwischen Pollenexposition und Atemwegssymptomen, und somit AWI, zeigt sich auch schon im Säuglingsalter, wie Schweizer Daten aus einer prospektiven Geburtskohorte gesunder Neugeborener, der Bern-Basel Infant Lung Development (BILD)-Kohorte, zeigen. Der Effekt der Pollenexposition auf die Häufigkeit von Atemwegssymptomen war dabei unabhängig von Allergien bei der Mutter oder vom Geschlecht der Säuglinge(20). Insgesamt bedeutet dies, dass während der Pollensaison die Prävention von Atemwegsinfektionen bei atopischen als auch nicht-atopischen Menschen hilfreich sein könnte, und zwar insbesondere bei Risikopatient:innen – z.B. Personen mit Asthma und COPD, aber auch bei Kindern mit rezidivierenden viralen AWI.
Strategien zur Prävention von Atemwegsinfektionen im Kindesalter
Zur Prävention von AWI bei Kindern stehen verschiedene Massnahmen zur Verfügung, die das Immunsystem stimulieren und die Infektanfälligkeit verringern können. Ein zentraler Risikofaktor, der klar mit einer erhöhten Infektanfälligkeit verbunden ist, ist die Exposition gegenüber Tabakrauch. Zahlreiche Studien belegen, dass Kinder, die regelmässig Tabakrauch in ihrer Umgebung ausgesetzt sind, häufiger an akuten respiratorischen Infektionen wie Bronchitis, Otitis media und Pneumonie erkranken(21). Darüber hinaus zählen ein gesunder Lebensstil mit ausgewogener Ernährung, ausreichendem Schlaf und regelmässiger körperlicher Aktivität zu den bewährten Strategien, die die kindliche Immunfunktion stärken können(22). Auch die Rolle von Mikronährstoffen wie Vitamin D, Zink und Vitamin C wurde in zahlreichen Studien untersucht. Diese Nährstoffe sind an vielen immunologischen Prozessen beteiligt, etwa durch Förderung der Schleimhautintegrität, antioxidative Eigenschaften oder Unterstützung der zellulären Immunantwort. Trotz ihrer biologischen Bedeutung zeigen systematische Übersichtsarbeiten und Metaanalysen jedoch keinen konsistenten präventiven Effekt auf das Auftreten akuter respiratorischer Infektionen bei Kindern(23, 24, 25). Darüber hinaus könnten auch probiotische und präbiotische Substanzen, wie zum Beispiel β-Glucane, einen Beitrag zur Infektprävention leisten, insbesondere über Mechanismen des sogenannten Darm-Lungen-Achsen-Konzepts. Diese Substanzen wirken potenziell durch die Stärkung der Schleimhautimmunität im Respirationstrakt. Bisherige Studien zeigen vielversprechende Hinweise auf eine Reduktion von Symptomen und Infekthäufigkeit – jedoch ist die Datenlage insbesondere bei Kindern noch nicht ausreichend, um allgemeingültige Empfehlungen abzuleiten(26, 27).
Immunmodulation durch Bakterienlysate – ein ergänzender Ansatz
Als gezielte Erweiterung der allgemeinen Präventionsmassnahmen gewinnt die Immunmodulation mit Bakterienlysaten zunehmend an Bedeutung – insbesondere bei Kindern mit rezidivierenden Infektionen oder mit Risikofaktoren wie Asthma und atopischen Erkrankungen. Bakterienlysate sind standardisierte Lysate aus mehreren Bakterienstämmen, die typischerweise aus Patient:innen mit rezidivierenden Atemwegsinfektionen gewonnen wurden, und die das Immunsystem auf mehreren Ebenen stimulieren. Ein umfangreicher Bestand an Daten aus präklinischen Studien hat einige der Wirkmechanismen aufgedeckt(28). Diese sind vielfältig und komplex – genauso wie die Immunprozesse in der Lunge. Die Prävention mit Bakterienlysaten basiert auf der Modulation mehrerer Immunsignalwege, insbesondere im Epithel, in den dendritischen Zellen sowie den regulatorischen T-Lymphozyten(29, 30). Zu den Hauptwirkungen von Bakterienlysaten gehört die Stimulation der Produktion der antiviralen Interferone α und β(31, 32), die, wie oben erwähnt, durch Pollen herunterreguliert werden können. Eine weitere bedeutende Wirkung besteht darin, eine übermässige Entzündung zu verhindern, indem die Expression einer Reihe von proinflammatorischen Genen gehemmt wird(33, 34). Darüber hinaus modulieren Bakterienlysate das bronchiale Immunsystem dahingehend, eine Entzündungsreaktion zu verlangsamen und die antiviralen Abwehrkräfte besser zu aktivieren(35). Daher stärkt die Immunmodulation durch Bakterienlysate die antiviralen Abwehrkräfte der Lunge und verbessert so die Kontrolle über Entzündungen in den Epithelzellen, was sich in messbaren klinischen Ergebnissen zeigt.
Klinische Effekte der Prävention durch Bakterienlysate
Zahlreiche klinische Studien haben gezeigt, dass Bakterienlysate bei Betroffenen mit Asthma, COPD oder Allergien sowie bei Kindern mit häufigen viralen AWI eine relevante Reduktion von respiratorischen Infektionen bewirken können. Eine Cochrane-Metaanalyse von 38 Studien ergab, dass die Häufigkeit von AWI bei Kindern um 39 % reduziert wurde(36). In einer weiteren Metaanalyse wurde auch eine deutliche Reduktion der Häufigkeit und des Schweregrades von Asthmaanfällen und Wheezing im Zusammenhang mit AWI bei Kindern festgestellt(37). Vergleichbare Ergebnisse wurden auch bei Personen mit atopischer Veranlagung sowie bei COPD berichtet. Bei Betroffenen im Alter von 16 bis 65 Jahren mit COPD, Asthma oder allergischer Rhinitis führte die Behandlung mit Bakterienlysaten zu einer signifikanten Reduktion der Anzahl von Exazerbationen (Abb. 2A) und Atemwegsinfektionen (Abb. 3A) um rund 33 % bzw. 29%(38). Das Risiko, an pulmonalen Exazerbationen zu erkranken, konnte in derselben Studie für Asthmatiker:innen um 33% und für Menschen mit COPD immerhin um 13% gesenkt werden (Abb. 2B), während sich das Risiko für Atemwegsinfektionen um 33% bzw. 50% reduzierte (Abb. 3B). In den vorliegenden Studien zeigte sich zudem eine gute Verträglichkeit von Bakterienlysaten für alle Altersgruppen. Derzeit werden mehrere grosse randomisierte klinische Studien schwerpunktmässig bei Kindern durchgeführt, welche speziell die Primär- und Sekundärprävention von Wheezing und Asthmaanfällen sowie die Verhinderung von rezidivierenden Infektionen und Wheezing durch Bakterienlysate untersuchen(39, 40).
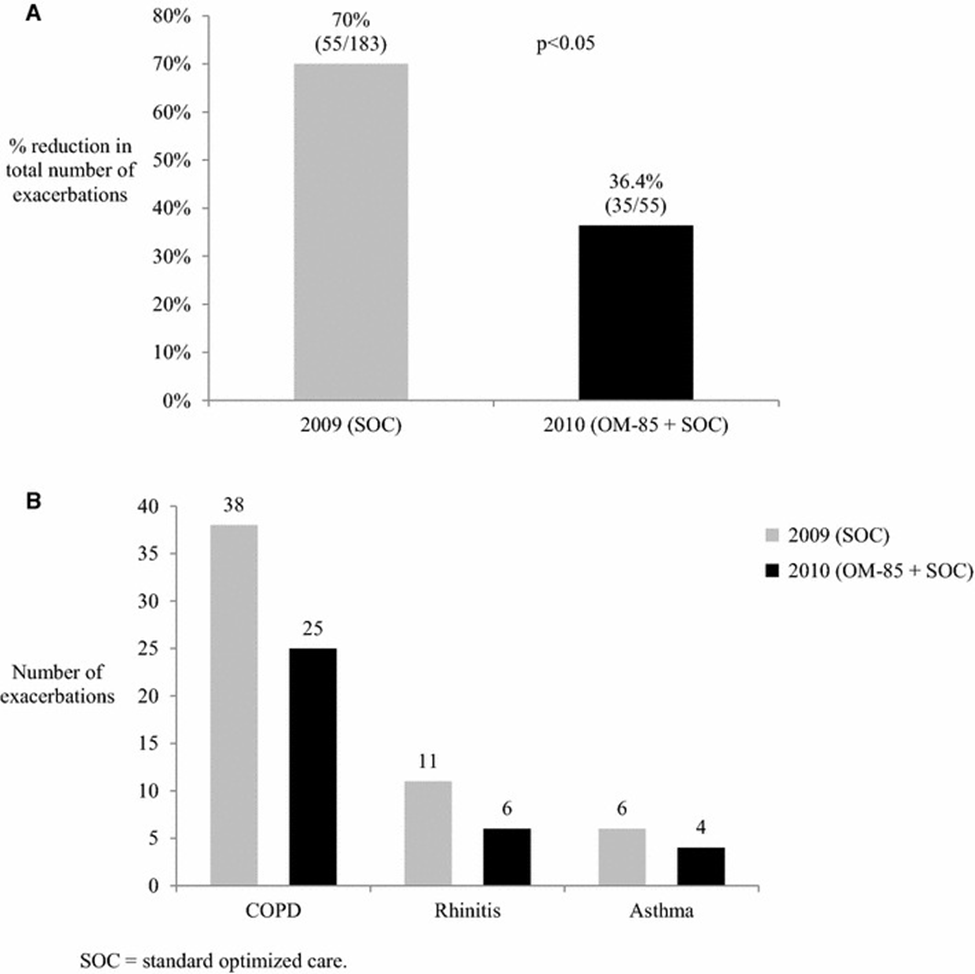
A Rückgang der Anzahl von pulmonalen Exazerbationen in den Jahren 2009 (versus 2008) und 2010 (versus 2009) unter einem Bakterienlysat zusätzlich zur Standardtherapie (mit Genehmigung von (38)).
B Anzahl der pulmonalen Exazerbationen bei Betroffenen mit COPD, allergischer Rhinitis und Asthma in den Jahren 2009 versus 2010.
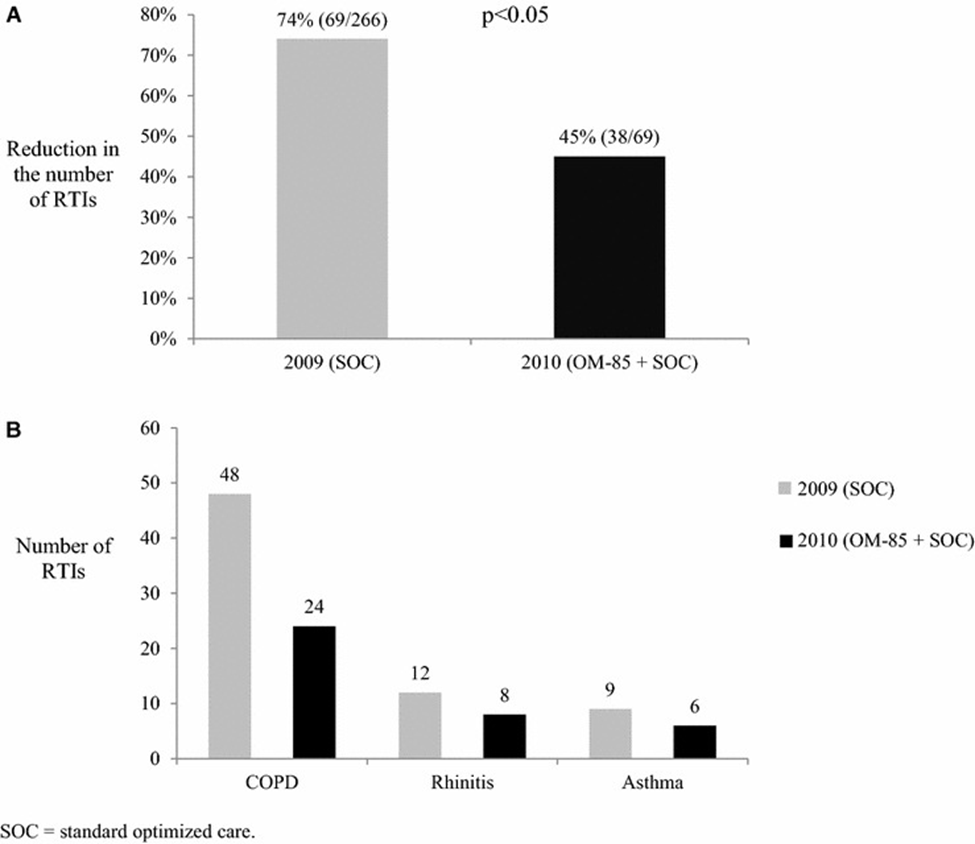
A Rückgang der Anzahl von Atemwegsinfekten in den Jahren 2009 (versus 2008) und 2010 (versus 2009) unter einem Bakterienlysat zusätzlich zur Standardtherapie (mit Genehmigung von (38)).
B Anzahl der Atemwegsinfektionen bei Betroffenen mit COPD, allergischer Rhinitis und Asthma in den Jahren 2009 versus 2010.
Zusammenfassung und Ausblick
In zahlreichen klinischen Situationen gilt es, die Häufigkeit von viralen Atemwegsinfektionen zu verringern, um langfristige Komplikationen zu vermeiden und die Lebensqualität zu erhalten. In diesem Zusammenhang kommt der Prävention eine zunehmende Bedeutung zu. Insbesondere aus Erkenntnissen der COVID-19-Pandemie wird sie zudem besser verstanden und akzeptiert. Daher ist jede wirksame Form der Prävention willkommen, seien es Masken für spezifische Risikogruppen, Impfungen und/oder Immunmodulation, v.a. durch Bakterienlysate. Dies gilt umso mehr als der Klimawandel, die Luftverschmutzung und die Allergien die Atemwege stark belasten – und die voraussichtliche zukünftige Entwicklung gibt derzeit keinen Anlass zum Optimismus. Hier bietet sich der Hinweis auf zwei Schweizer prospektiven Kohorten an, welche die Entwicklung der Lungengesundheit von Schweizer Kindern in Echtzeit verfolgen und wertvolle Erkenntnisse liefern werden: BILD (Bern Basel Infant Lung Development)(41) und SPAC (Swiss Paediatric Airway Cohort)(19). Diese Studien können dazu beitragen, Risikofaktoren besser zu verstehen und präventive Massnahmen im Langzeitverlauf zu evaluieren.
Referenzen
- Belachew AB, Rantala AK, Jaakkola MS, Hugg TT, Jaakkola JJ (2023). Asthma and respiratory infections from birth to young adulthood: The Espoo cohort study. Am J Epidemiol, 192(3):408-419.
- Romero-Tapia SDJ, Guzmán Priego CG, Del-Río-Navarro BE, Sánchez-Solis M (2023). Advances in the relationship between respiratory viruses and asthma. J Clin Med, 12(17):5501.
- Whittaker H, Nordon C, Rubino A, Morris T, Xu Y, De Nigris E et al. (2023). Frequency and severity of respiratory infections prior to COPD diagnosis and risk of subsequent postdiagnosis COPD exacerbations and mortality: EXACOS-UK health care data study. Thorax, 78(8):760-766.
- Edwards MR, Strong K, Cameron A, Walton RP, Jackson DJ, Johnston, SL (2017). Viral infections in allergy and immunology: how allergic inflammation influences viral infections and illness. J Allergy Clin Immunol, 140(4):909-920.
- Choi YI, Lee KS, Lee YS, Kim KR, Oh JW (2022). Analysis of the association among air pollutants, allergenic pollen, and respiratory virus infection of children in Guri, Korea during recent 5 Years. Allergy Asthma Immunol Res; 14(3):289-299.
- Endaryanto A, Darma A, Sundjaya T, Masita BM, Basrowi RW (2023). The notorious triumvirate in pediatric health: Air pollution, respiratory allergy, and infection. Children; 10(6):1067.
- Martinez FD (2016). Early-life origins of chronic obstructive pulmonary disease. New Engl J Med; 375(9):871-878.
- Svanes C, Sunyer J, Plana E, Dharmage S, Heinrich J, Jarvis D et al. (2010). Early life origins of chronic obstructive pulmonary disease. Thorax, 65(1):14-20.
- Gilles S, Blume C, Wimmer M, Damialis A, Meulenbroek L, Gökkaya M et al. (2020). Pollen exposure weakens innate defense against respiratory viruses. Allergy, 75(3):576-587.
- Hsu, AC, Parsons K, Barr I, Lowther S, Middleton D, Hansbro PM et al. (2012). Critical role of constitutive type I interferon response in bronchial epithelial cell to influenza infection. PloS One, 7(3):e32947.
- Dbouka T, Drikakisb D (2021). On pollen and airborne virus transmission. Phys. Fluids, 33:063313.
- Epstein TEG, Rorie AC, Ramon GD, Keswani A, Bernstein J, Codina R et al. (2025). Impact of climate change on aerobiology, rhinitis, and allergen immunotherapy: Work Group Report from the Aerobiology, Rhinitis, Rhinosinusitis & Ocular Allergy, and Immunotherapy, Allergen Standardization & Allergy Diagnostics Committees of the American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol; S0091-6749(25)00268-4. doi: 10.1016/j.jaci.2025.01.048. Online ahead of print.
- Wan H, Winton HL, Soeller C, Tovey ER, Gruenert DC, Thompson, PJ et al. (1999). Der p1 facilitates transepithelial allergen delivery by disruption of tight junctions. J Clin Invest; 104(1):123-133.
- Monoson A, Schott E, Ard K, Kilburg-Basnyat B, Tighe RM, Pannu S et al. (2023). Air pollution and respiratory infections: The past, present, and future. Toxicol Sciences; 192(1):3-14.
- Hussey SJ, Purves J, Allcock N, Fernandes VE, Monks PS, Ketley JM, et al. (2017). Air pollution alters Staphylococcus aureus and Streptococcus pneumoniae biofilms, antibiotic tolerance and colonisation. Environment Microbiol, 19(5):1868-1880.
- Sun N, Ogulur I, Mitamura Y, Yazici D, Pat Y, Bu X et al. (2024). The epithelial barrier theory and its associated diseases. Allergy; 79(12):3192-3237.
- Holt PG, Upham JW, Sly PD (2017). Contemporaneous maturation of immunologic and respiratory functions during early childhood: implications for development of asthma prevention strategies. J Allergy Clin Immunol; 116(1):16-24.
- Damialis A, Gilles S, Sofiev M, Sofieva V, Kolek F, Bayr D et al. (2021). Higher airborne pollen concentrations correlated with increased SARS-CoV-2 infection rates, as evidenced from 31 countries across the globe. Proc Nat Acad Sciences; 118(12):e2019034118.
- Sundell N, Andersson LM, Brittain-Long R, Lindh M, Westin J (2016). A four year seasonal survey of the relationship between outdoor climate and epidemiology of viral respiratory tract infections in a temperate climate. J Clin Virol; 84:59-63.
- Gisler A, Eeftens M, de Hoogh K, Vienneau D, Salem Y, Yammine S et al. (2022). Pollen exposure is associated with risk of respiratory symptoms during the first year of life. Allergy; 77(12):3606-3616.
- Jones LL, Hashim A, McKeever T, Cook DG, Britton J, Leonardi-Bee J (2011). Parental and household smoking and the increased risk of bronchitis, bronchiolitis and other lower respiratory infections in infancy: systematic review and meta-analysis. Respir Res; 12(1):5.
- Chastin FM, Abaraogu U, Bourgois JG, Dall PM, Darnborough J, Duncan E et al. (2021). Effects of regular physical activity on the immune system, vaccination and risk of community-acquired infectious disease in the general population: Systematic review and meta-analysis. Sports Med 51(8):1673-1686.
- Hemilä H, Chalker E (2013). Vitamin C for preventing and treating the common cold. Cochrane Database Syst Rev; 2013(1):CD000980.
- Carboo JA, Dolman-Macleod RC, Malan L, Lombard MJ (2024). High-dose oral vitamin D supplementation for prevention of infections in children aged 0 to 59 months: a systematic review and meta-analysis. Nutr Rev; 82(5):579-599.
- Nault D, Machingo TA, Shipper AG, Antiporta DA, Hamel C, Nourouzpour S et al. (2024). Zinc for prevention and treatment of the common cold. Cochrane Database Syst Rev; 5(5):CD014914.
- Zhong K, Liu Z, Lu Y, Xu X (2021). Effects of yeast β-glucans for the prevention and treatment of upper respiratory tract infection in healthy subjects: a systematic review and meta-analysis. Eur J Nutr; 60(8):4175-4187.
- Vlassopoulou M, Yannakoulia M, Pletsa V, Zervakis GI, Kyriacou A (2021). Effects of fungal beta-glucans on health – a systematic review of randomized controlled trials. Food Funct; 12(8):3366-3380.
- Ballarini S, Ardusso L, Ortega Martell JA, Sacco O, Feleszko W, Rossi GA (2022). Can bacterial lysates be useful in prevention of viral respiratory infections in childhood? The results of experimental OM-85 studies. Front Pediatr; 10:1051079.
- Strickland DH, Judd S, Thomas JA, Larcombe AN, Sly PD, Holt PG (2011). Boosting airway T-regulatory cells by gastrointestinal stimulation as a strategy for asthma control. Mucos Immunol; 4(1):43-52.
- Pasquali C, Salami O, Taneja M, Gollwitzer ES, Trompette A, Pattaroni C et al. (2014). Enhanced mucosal antibody production and protection against respiratory infections following an orally administered bacterial extract. Front Med; 1:41.
- Dang AT, Pasquali C, Ludigs K, Guarda G (2017). OM-85 is an immunomodulator of interferon-β production and inflammasome activity. Scientific Reports; 7(1):43844.
- Pivniouk V, Gimenes-Junior JA, Ezeh P, Michael A, Pivniouk O, Hahn S et al. (2022). Airway administration of OM-85, a bacterial lysate, blocks experimental asthma by targeting dendritic cells and the epithelium/IL-33/ILC2 axis. J Allergy Clin Immunol; 149(3):943-956.
- Kaczynska A, Klosinska M, Janeczek K, Zarobkiewicz M, Emeryk A (2022). Promising immunomodulatory effects of bacterial lysates in allergic diseases. Front Immunol; 13:907149.
- Scott NM, Lauzon-Joset JF, Jones AC, Mincham KT, Troy NM, Leffler J et al (2017). Protection against maternal infection-associated fetal growth restriction: Proof-of-concept with a microbial-derived immunomodulator. Mucos Immunol; 10(3):789-801.
- Troy NM, Strickland D, Serralha M, de Jong E, Jones AC, Read J et al. (2022). Protection against severe infant lower respiratory tract infections by immune training: Mechanistic studies. J Allergy Clin Immunol; 150(1):93-103.
- Del‐Rio‐Navarro BE, Espinosa‐Rosales FJ, Flenady V, Sienra‐Monge JJ (2006). Cochrane Review: Immunostimulants for preventing respiratory tract infection in children. Cochrane Database Syst Rev; CD004974, doi: 10.1002/14651858.
- De Boer GM, Żółkiewicz J, Strzelec KP, Ruszczyński M, Hendriks RW, Braunstahl GJ et al. (2020). Bacterial lysate therapy for the prevention of wheezing episodes and asthma exacerbations: a systematic review and meta-analysis. European Respiratory Review; 29(158).
- Koatz AM, Coe NA, Cicerán A, Alter AJ (2016). Clinical and immunological benefits of OM-85 bacterial lysate in patients with allergic rhinitis, asthma, COPD and recurrent respiratory infections. Lung; 194:687-697.
- BEAR-Studie: OM-85 in paediatric recurrent respiratory tract infections with wheezing lower respiratory illness. ClinicalTrials.gov ID NCT05677763; https://clinicaltrials.gov/study/NCT05677763, letztmals aufgerufen 11.05.2025
- ORBEX-Studie: Oral bacterial extract for the prevention of wheezing lower respiratory tract illness. ClinicalTrials.gov ID NCT02148796; https://clinicaltrials.gov/study/NCT02148796, letztmals aufgerufen am 11.05.2025.
- Salem Y, Jakob J, Steinberg R, Gorlanova O, Fuchs O, Müller L et al. (2023). Cohort Profile Update: The Bern Basel Infant Lung Development Cohort. Int J Epidemiol; 53(1):dyad164. doi: 10.1093/ije/dyad164.
Weitere Informationen
Autor:innen
-
Dr. med. Andreas JungPädiatrische Pneumologie, Kantonsspital Winterthur, Zentrum für Kinder und Jugendliche, Winterthur
-
PD Dr. med. Oliver FuchsAllergologie, Zentrum Dermatologie und Allergologie, Departement Medizin, Luzerner Kantonsspital sowie Universität Luzern und Universität Bern
-
Dr. med. Philipp LatzinPädiatrische Pneumologie, Universitätskinderklinik Bern, Inselspital Bern, Universität Bern
-
Prof. Dr. med. Johannes WildhaberPädiatrie, Kantonspital Fribourg und Universität Fribourg, Fribourg
-
Prof. Dr. med. Nicolas RegameyPädiatrische Pneumologie, Kinderspital Zentralschweiz, Luzern und Pädiatrische Pneumologie, Universitatskinderklinik Bern, Inselspital Bern
