Les tumeurs du système nerveux central (SNC) sont la cause oncologique de morbidité et de mortalité la plus fréquente chez l’enfant et l’adolescent1),2). Les défis pendant toute l’évolution de la maladie, des premiers symptômes jusqu’aux effets à long terme et le risque de rechute en passant par le moment du diagnostic, sont multiples et considérables pour les enfants concernés et leurs familles.
Les tumeurs cérébrales sont hétérogènes. Elles peuvent se manifester dans tout le SNC (cerveau et moelle épinière) et avoir des présentations cliniques très variées, dépendantes de leur localisation, de l’âge du patient et de l’histologie tumorale. La classification histologique selon l’OMS comporte quatre grades.
Les tumeurs de bas grade comprenant les grades I et II se caractérisent par une croissance lente; elles peuvent néanmoins être infiltratives et former des métastases. Les tumeurs de grade élevé ont une croissance rapide et l’aspect des cellules tumorales est très varié. Dans la majorité des cas, des traitements multimodaux sont nécessaires, incluant la chirurgie suivie de chimio- et/ou radiothérapie.
Bien que ces dernières années on puisse constater quelques progrès concernant les taux de survie, ceux-ci ne sont pas aussi fulgurants que pour s’autres cancers (leucémies p.ex.). Les effets tardifs de la tumeur et du traitement sont souvent sévères, notamment pour les petits enfants. Alors qu’une équipe pluridisciplinaire est décisive pour garantir une prise en charge selon les dernières connaissances de la recherche ainsi que le suivi à long terme, la responsabilité de la détection de cette maladie hétérogène et relativement rare incombe au pédiatre praticien et au médecin urgentiste. L’étroite collaboration entre pédiatres praticiens et oncologues pédiatres hospitaliers est un facteur essentiel pour la prise en charge de ces enfants et adolescents.
Classification et épidémiologie des tumeurs cérébrales
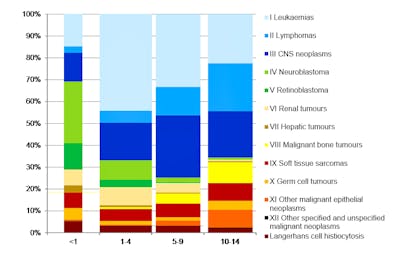
Les tumeurs du SNC sont, après les leucémies, le deuxième type de cancer le plus fréquent chez l’enfant. Elles correspondent à environ ¼ de tous les nouveaux diagnostics de cancer pendant l’enfance. En Suisse on diagnostique annuellement 40-50 cas chez des enfants jusqu’à 14 ans, avec un pic entre 5 et 9 ans1).
Du point de vue histologique il s’agit le plus souvent de gliomes, un groupe hétérogène de tumeurs pouvant se manifester dans n’importe quelle partie du cerveau. Ils comprennent des lésions à croissance lente de degré I-II OMS et aussi des gliomes de degré élevé III-IV OMS.
Avec env. 50% les gliomes de bas-grade sont les tumeurs cérébrales les plus nombreuses de l’enfant1). Se trouvant souvent dans la ligne médiane ils ne peuvent, malgré leur histologie de bas-grade, pas toujours bénéficier d’un traitement chirurgical. Leur évolution est donc souvent chronique avec une morbidité et mortalité (>10 ans après le diagnostic) importantes. Les gliomes de haut-grade, comprenant e.a. les glioblastomes et les gliomes infiltrants du tronc cérébral, ont un pronostic globalement mauvais, dépendant de l’âge au moment du diagnostic.
Un autre groupe relativement important est celui des tumeurs embryonnaires. La forme la plus fréquente est le médulloblastome, avec un grade OMS IV; néanmoins il est possible d’atteindre un taux de survie de 70-80%.
Le diagnostic moléculaire a révolutionné ces dernières années le diagnostic des tumeurs cérébrales – un diagnostic purement histologique ou par immunohistochimie n’est de nos jours plus suffisant. Au premier plan sont actuellement les analyses par méthylation de l’ADN du tissu tumoral et le séquençage d’un panel de gènes, afin de découvrir des modifications du génome tumoral. Ces méthodes permettent une caractérisation précise de la tumeur, ouvrant de nouvelles options thérapeutiques. Ces nouvelles possibilités diagnostiques nécessiteront dans un futur proche une nouvelle classification des tumeurs cérébrales.
Étiologie et lien avec les syndromes prédisposant aux cancers
L’étiologie des tumeurs du SNC chez les enfants et les adolescents est largement inconnue. De nombreuses études ont examiné la relation entre les influences environnementales et infectieuses, et seule l’exposition aux rayonnements ionisants a été identifiée comme étant un facteur de risque.
Environ 10% des tumeurs de l’enfant et de l’adolescent apparaissent dans le contexte de syndromes prédisposant aux cancers (SPC) 3), une petite proportion, néanmoins pas insignifiante. Il existe plusieurs SPC associés à des tumeurs cérébrales pédiatriques, les plus importants étant la neurofibromatose de type 1 (mutation du gène NF1, associée aux gliomes de bas-grade), le syndrome de Li-Fraumeni (mutation de lignée germinale en TP53, associée aux gliomes de haut-grade, médulloblastome, carcinome du plexus choroïde, e.a.), déficience du système de réparation des mésappariements de l’ADN (associé à des tumeurs de haut-grade) et le syndrome prédisposant à une tumeur rhabdoïde (mutation de lignée germinale SMARCB1, associée à une tumeur rhabdoïde tératoïde atypique (ATRT).
Le diagnostic précoce de ces SPC est crucial, les enfants concernés pouvant ainsi être inclus dans un vaste programme de dépistage précoce.
Présentation clinique
La présentation clinique est très hétérogène et dépend essentiellement de la localisation de la tumeur et de l’âge du patient4).
La Fondation allemande pour le cancer de l’enfant a développé en collaboration avec des groupes d’étude des tumeurs cérébrales, au sein du réseau de traitement HIT de la Société allemande d’hématologie et oncologie pédiatriques (GPOH), un dépliant pour faciliter le dépistage précoce des tumeurs du SNC pendant l’enfance et l’adolescence (figure 1).

Outre les symptômes mentionnés, pendant l’enfance le dépistage précoce se base aussi sur la mesure du périmètre crânien, du poids et de la taille. Une croissance excessive du crâne, croisant les percentiles, un retard de croissance staturo-pondéral chronique ou une puberté précoce doivent aussi faire évoquer une tumeur cérébrale.
Dépistage précoce: le rôle du pédiatre
Alors que certains enfants peuvent se présenter aux urgences suite à l’apparition soudaine de symptômes comme des troubles moteurs focaux ou de l’état de conscience (signe souvent tardif) et sont diagnostiqués par l’imagerie, la plupart parcourent des semaines voire des mois de symptômes avant qu’on ne pose un diagnostic5),6).
Malgré la large disponibilité de l’imagerie par résonance magnétique, il est décevant de constater que l’intervalle entre les premiers symptômes et le diagnostic est resté inchangé. Des campagnes de sensibilisation pour parents et médecins de premier recours (la campagne HeadSmart au Royaume Uni ou la campagne FIT en Allemagne) ont eu par contre un effet positif5).
De longs intervalles entre premiers symptômes et diagnostic s’observent surtout pour les gliomes de bas- grade, la symptomatologie étant chronique et ne se dégradant que lentement.
Des consultations répétées avec des symptômes chroniques, notamment des résultats scolaires ou des fonctions motrices qui se dégradent, devraient évoquer la possibilité d’une tumeur cérébrale. L’anamnèse familiale détaillée peut livrer des indices concernant d’éventuels SPC.
L’examen clinique inclura toujours la croissance (périmètre crânien compris), les signes pubertaires, un examen neurologique, ophtalmologique (réflexes pupillaires, motricité oculaire, champ visuel et fundoscopie) et dermatologique (dépistage de signes d’un SPC, p.ex. taches café-au-lait de NF1).
Certains scénarios cliniques sont particulièrement ardus et souvent associés à un long intervalle entre premiers symptômes et diagnostic5). Par exemple un retard du développement staturo-pondéral associé à des nausées/vomissements en absence d’une cause gastroentérologique. Cela doit toujours évoquer la possibilité d’un syndrome diencéphalique causé par un gliome de bas-grade. Les symptômes classiques dus à une augmentation de la pression intracrânienne, les céphalées et les vomissements à jeûn, ne sont pas toujours reconnus non plus.
Premières investigations
Le choix de l’imagerie devrait toujours privilégier l’IRM avec produit de contraste, indépendamment de l’âge et de la nécessité d’une anesthésie. Pour cette raison l’examen devrait toujours être fait dans un centre spécialisé, disposant notamment d’un service de neuroradiologie. Le CT-scan ne devrait être utilisé que dans des cas exceptionnels et ne remplace pas l’IRM.
Les enfants et adolescents avec une tumeur du SNC nouvellement diagnostiquée devraient être transférés dans un centre d’oncologie pédiatrique, spécialisé dans les traitements neurochirurgicaux et neuro-oncologiques.
Le diagnostic d’une tumeur intracrânienne devrait toujours être complété par une IRM de la moelle épinière – si possible directement après l’IRM cérébrale – afin d’exclure des métastases macroscopiques. Bien que ce soient plutôt les tumeurs de haut-grade comme les médulloblastomes, épendymomes ou tumeurs tératoïdes/rhabdoïdes atypiques (ATRT) à avoir tendance à développer des métastases le long du SNC, les tumeurs de bas-grade I/II OMS peuvent aussi présenter des localisations disséminées. Les métastases des tumeurs du SNC ne se trouvent presque qu’exclusivement dans le SNC, on ne procède donc pas de routine à un staging plus étendu.
Les enfants avec une tumeur suprasellaire devraient bénéficier d’un examen endocrinien afin d’évaluer, avant une intervention chirurgicale, la fonction hypophysaire. Un examen des fonctions oculaires est indiqué chez les patients avec une hydrocéphalie obstructive ou œdème papillaire tout comme en présence d’une tumeur suprasellaire ou de lésions des voies optiques.
Traitement
En règle générale le premier geste thérapeutique est chirurgical, pour obtenir un diagnostic histologique mais aussi pour soulager une hydrocéphalie lors de tumeurs obstruant le flux du liquide céphalorachidien (LCR). L’intervention chirurgicale peut aller du petit geste thérapeutique endoscopique ou robotisé jusqu’à la résection totale de la tumeur. Ces interventions devraient être effectuées par un neurochirurgien expérimenté, ayant un certain nombre d’interventions par année à son actif et/ou une formation en neurochirurgie pédiatrique. Outre la neurochirurgie, la prise en charge des patients pendant cette phase délicate dépend aussi de l’anesthésie et des soins intensifs. Il s’agit donc d’interventions hautement spécialisées qui ne devraient être pratiqués que dans les centres correspondants.
Certaines tumeurs comme les gliomes des voies optiques d’une NF1 peuvent être diagnostiquées par imagerie uniquement et ne nécessitent pas de confirmation histologique.
Par ailleurs pas toutes les tumeurs de l’enfant ou de l’adolescent exigent un traitement. Pour de petits gliomes de bas-grade sans troubles neurologiques, on se limite souvent à observer l’évolution; même plus tard ils ne nécessitent pas toujours de traitement.
Pour les tumeurs de haut-grade, la prochaine étape thérapeutique est souvent la radiothérapie. Selon le type de tumeur l’irradiation sera locale ou sur le cerveau entier, voire cranio-spinale pour les tumeurs métastasant fréquemment. L’irradiation se fait soit par photons ou par protons. Un centre de traitement par protons existe depuis longtemps en Suisse (le PSI à Villigen), où sont traités de nombreux enfants et adolescents.
L’avantage du traitement par protons est l’irradiation plus ciblée, minimisant le rayonnement diffusé sur le tissu sain avoisinant. Il s’agit surtout de réduire les troubles neurocognitifs tardifs. En raison de l’âge du patient la radiothérapie doit souvent être effectuée en narcose, ce qui exige des équipes d’anesthésie spécialisées. À cause des effets indésirables à long terme on ne procède qu’exceptionnellement à la radiothérapie chez le très petit enfant (<3 ans).
Le troisième élément thérapeutique est la chimiothérapie, possible malgré la barrière hémato-encéphalique. Il n’existe par contre que peu d’agents chimiothérapeutiques passant dans le LCR et pouvant donc être utilisés. La chimiothérapie revêt une grande importance chez les petits enfants, les effets indésirables tardifs étant moins sévères qu’après une radiothérapie.
Pour remplacer resp. retarder la radiothérapie chez le petit enfant, différents concepts ont été développés: par l’administration directe d’agents chimiothérapeutiques dans le liquide céphalo-rachidien au moyen d’un cathéter et réservoir spécial (Omaya), ou par une chimiothérapie hautement dosée suivie de la transplantation de cellules souches autologues.
Outre les stratégies de traitement classiques, ces dernières années ont été développées des thérapies ciblées, traitements qui présument une description biologique détaillée de la tumeur.
Les gliomes de bas-grade par exemple présentent des modifications dans la voie MAPK qu’il est possible d’exploiter à des fins thérapeutiques. Les traitements ciblés nécessitent eux aussi une vérification de l’efficacité et des effets indésirables, ce que réalise l’actuelle étude européenne LOGGIC à laquelle participe aussi la Suisse.
Les traitements des tumeurs du SNC ne sont possibles que dans le cadre d’études internationales – la Suisse est membre du groupe d’étude germanophone HIT et du Groupe d’étude européen des tumeurs cérébrales.
Pronostic et suivi
Au cours des dernières décennies, le pronostic des tumeurs du SNC s’est considérablement amélioré – toutefois avec de grandes différences selon le groupe de tumeurs. Cela varie d’une très bonne survie globale à un pronostic – presque toujours – peu optimiste dans le cas d’un gliome du tronc cérébral à infiltration diffuse.
La qualité de la survie est très difficile dans le cas des tumeurs du SNC – la tumeur et les thérapies ont toutes deux un taux de morbidité élevé, surtout chez les enfants les plus jeunes au moment du diagnostic. Cela concerne les conséquences tardives neurologiques et endocrinologiques, mais aussi les conséquences tardives neurocognitives graves avec des limitations massives dans la formation et la vie professionnelle ultérieure.
Une réadaptation spécialisée dans des cliniques de réadaptation appropriées telles que Katharinenhöhe ou Tannheim est très importante pour ce groupe afin de permettre une réintégration rapide mais aussi à long terme dans la formation et la vie professionnelle.
Défis
La caractérisation biologique complexe des tumeurs du SNC par les nouvelles techniques engendre de multiples défis.
Ces techniques étant hautement spécialisées, elles sont centralisées et ne sont donc pas proposées dans tous les centres. Cela implique l’envoi des échantillons de tissu presque toujours aussi dans des pays européens, ce qui nécessite la mise en place d’une logistique adéquate.
La classification actuelle des tumeurs ne prenant pas suffisamment en compte ces nouvelles techniques, certaines tumeurs ne peuvent être attribuées à une entité précise. C’est pourquoi des tumor boards interdisciplinaires sont essentiels, pour discuter les résultats et élaborer les stratégies de traitement avec tous les experts. Ce défi ne peut être relevé que par une coopération internationale.
Par la découverte de nombreux facteurs pronostiques, les différents groupes de risque sont devenus plus restreints même au sein d’une seule entité tumorale. Sans collaboration internationale il ne serait plus possible d’élaborer un protocole thérapeutique. D’autre part la description détaillée des groupes de risque soulève aussi de nombreuses questions thérapeutiques, les moyens de traitement étant actuellement limités pour les groupes à haut risque.
La mise en œuvre de nouvelles options thérapeutiques exige une nouvelle conception des études d’optimisation thérapeutique afin de permettre l’implémentation continue des nouvelles approches thérapeutiques.
Références
- Ostrom QT, de Blank PM, Kruchko C, Petersen CM, Liao P, Finlay JL, et al. Alex’s Lemonade Stand Foundation Infant and Childhood Primary Brain and Central Nervous System Tumors Diagnosed in the United States in 2007-2011. Neuro-oncology. 2015;16 Suppl 10:x1-x36.
- Schindler M, Belle FN, Grotzer MA, von der Weid NX, Kuehni CE, Swiss Paediatric Oncology G. Childhood cancer survival in Switzerland (1976-2013): Time-trends and predictors. International journal of cancer Journal international du cancer. 2017;140(1):62-74.
- Zhang J, Walsh MF, Wu G, Edmonson MN, Gruber TA, Easton J, et al. Germline Mutations in Predisposition Genes in Pediatric Cancer. The New England journal of medicine. 2015;373(24):2336-46.
- Wilne S, Collier J, Kennedy C, Koller K, Grundy R, Walker D. Presentation of childhood CNS tumours: a systematic review and meta-analysis. Lancet Oncol. 2007;8(8):685-95.
- HeadSmart Be Brain Tumour A. A new clinical guideline from the Royal College of Paediatrics and Child Health with a national awareness campaign accelerates brain tumor diagnosis in UK children–« HeadSmart: Be Brain Tumour Aware ». Neuro-oncology. 2016;18(3):445-54.
- Coven SL, Stanek JR, Hollingsworth E, Finlay JL. Delays in diagnosis for children with newly diagnosed central nervous system tumors. Neurooncol Pract. 2018;5(4):227-33.
- Arnautovic A, Billups C, Broniscer A, Gajjar A, Boop F, Qaddoumi I. Delayed diagnosis of childhood low-grade glioma: causes, consequences, and potential solutions. Child’s nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2015;31(7):1067-77.