Les antibiotiques figurent parmi les médicaments les plus utilisés en pédiatrie1). Dans un contexte de résistances bactériennes croissantes contre les antibiotiques au courant de la dernière décennie, l’utilisation scrupuleuse et rationnelle de ces médicaments est apparue comme étant essentielle afin de conserver leur efficacité globalement le plus longtemps possible2). Les enfants et adolescent-e-s reçoivent, surtout dans le cadre ambulatoire, une quantité disproportionnée d’antibiotiques comparés aux adultes, des initiatives pour favoriser une antibiothérapie rationnelle sont donc particulièrement souhaitables en pédiatrie3).
Données concernant la prescription d’antibiotiques en Suisse
Indépendamment du pays ou de la région, environ 85-93% des prescription d’antibiotiques sont faites en ambulatoire, notamment en pédiatrie4). En Suisse les données concernant la consommation d’antibiotiques sont régulièrement publiées par Anresis, Centre suisse pour le contrôle de l’Antibiorésistance, géré par l’Institut de Maladies infectieuses de l’Université de Berne avec le soutien de l’Office fédéral de la santé publique (OFSP)5). On constate que la prescription des différentes classes d’antibiotiques aux enfants et adolescent-e-s, depuis la naissance jusqu’à l’âge de 17 ans, varie selon la tranche d’âge.
Chez les enfants jusqu’à deux ans dominent les pénicillines avec un spectre élargi (entre autres l’amoxicilline) et les combinaisons de pénicillines, notamment amoxicilline/acide clavulanique (co-amoxicilline). En 2020 les pénicillines à large spectre représentaient à elles seules 52% de la consommation totale d’antibiotiques des enfants de moins de deux ans (fig. 1). La situation est comparable pour les enfants de 2 à 11 ans, avec la prescription de pénicillines à large spectre (2020; 38% de la consommation totale), surtout co-amoxicilline (2020; 33% de la consommation totale) et de macrolides (2020; 10% de la consommation totale). À l’adolescence dominent les tétracyclines (2020; 33% de la consommation totale), prescrites essentiellement pour le traitement de l’acné.

Pour la Suisse il n’existe pas de données actuelles permettant d’évaluer l’utilisation ambulatoire des antibiotiques en fonction de l’indication. Des données allemandes montrent que 70% des prescriptions d’antibiotiques aux enfants et adolescent-e-s de moins de 15 ans sont faites pour des infections des voies respiratoires (25% amygdalite aiguë, 17% bronchite, 16% otite moyenne, 12% infections des voies respiratoires supérieures)6). Des proportions comparables ont été constatées aux USA, les indications mentionnées étant suivies des infections cutanées (12% de la consommation totale) et des infections urinaires (2%)7). En incluant la pneumonie communautaire on peut considérer que 75-80% de tous les antibiotiques prescrits en ambulatoire le sont pour des infections des voies respiratoires. Des données américaines suggèrent que les antibiotiques sont prescrits inutilement pour au moins 30-40% des infections des voies respiratoires; il existe donc dans ce domaine un potentiel considérable d’optimisation8).
Objectif de l’antibiothérapie rationnelle
L’objectif évident d’une antibiothérapie rationnelle est d’améliorer la pratique de prescription et ne traiter, de manière ciblée, que les patients qui profiteront avec une grande probabilité du traitement antibiotique. Un traitement rationnel se base donc sur une évaluation explicite des bénéfices et risques pour le patient dans une situation donnée.
Le traitement de maladies infectieuses d’origine bactérienne par des antibiotiques peut viser plusieurs objectifs. Dans les pays à haut revenu, un but thérapeutique fréquent en pédiatrie est d’éviter des complications à court et long terme. En réalité le nombre d’enfants qui doit être traité pour éviter un seul cas d’une complication typique, est en général très élevé voire inconnu. Le «Number Needed to Treat» lors d’une otite moyenne aiguë pour éviter un cas de mastoïdite se situe entre 2200 et 4500, et s’élève à presque 20’000 pour éviter un abcès cérébral9,10).
Plusieurs études randomisées montrent que dans certaines situations les antibiotiques peuvent raccourcir la durée de symptômes spécifiques. Souvent l’effet est néanmoins faible du point de vue clinique. Une évidence dans ce sens est rapportée par exemple pour le traitement de l’otite moyenne aiguë et de la pharyngite11,12).
Contrairement au vieux dicton paysan «Si cela ne sert à rien, cela ne peut au moins pas nuire» les effets indésirables lors de traitements antibiotiques par voie orale sont relativement fréquents, comme des éruptions cutanées non spécifiques (jusqu’à un enfant sur dix) et les diarrhées (jusqu’à un enfant sur dix traités avec amoxicilline et un sur cinq avec co-amoxicilline)13,14). Ces réactions peuvent être dérangeantes au point que les parents interrompent le traitement.
Il existe aussi des éléments indiquant que l’exposition répétée aux antibiotiques, surtout pendant la petite enfance, peut avoir des conséquences indésirables indirectes. Importants sont les troubles durables du microbiome, possiblement associés à une réponse immunologique moindre aux vaccins et à un impact indésirable sur certaines maladies chroniques (asthme, allergies, obésité)15,16).
Une antibiothérapie rationnelle doit donc maximiser les bénéfices directs et minimiser les risques pour les enfants et adolescent-e-s, sans mettre en danger les patient-e-s. En règle générale cela aboutit indirectement à une utilisation moins fréquente et plus ciblée des antibiotiques, et mène ainsi à une pression moindre sur la sélection bactérienne et un effet globalement positif sur la situation globale des résistances antimicrobiennes.
Une structure – aide à une antibiothérapie rationnelle
Pour la pratique quotidienne il est recommandé de structurer l’utilisation des antibiotiques en prenant en compte plusieurs aspects, à l’aide desquels évaluer la manière de prescrire l’antibiotique dans le cas particulier. En anglais ces aspects se résument en cinq «D» essentiels: Disease (indication), Drug (choix de l’antibiotique), Dose (dosage), Delivery (galénique/mode d’administration) et Duration (durée du traitement). Pour une antibiothérapie optimale tous les cinq aspects doivent être pris en considération; s’il n’existe par contre pas d’indication claire pour un traitement antibiotique, des considérations ultérieures sont souvent superflues.
Afin de favoriser le traitement rationnel, l’Organisation Mondiale de la Santé (OMS) a développé la classification AWaRe17). Cette classification répartit les antibiotiques en «Access», «Watch» et «Reserve». Le groupe «Access» comprend les antibiotiques de premier choix pour une indication donnée et ayant un faible potentiel de sélection pour des résistances. Dans le groupe «Watch» sont compris les antibiotiques qui ne devraient pas être utilisés en première intention et qui ont en général un risque plus élevé de sélectionner des bactéries résistantes18). Le groupe «Reserve» joue un rôle négligeable dans le cadre ambulatoire.
Il s’agit au niveau international de prescrire en priorité les antibiotiques du groupe «Access» et d’évaluer les données régionales ou nationales sur l’utilisation des antibiotiques aussi selon la classification AWaRe. Globalement au moins 60% des antibiotiques prescrits devraient appartenir au groupe «Access»; selon l’approche et la population cible peuvent être visées des proportions d’antibiotiques «Access» plus importantes19).
Pour l’utilisation des antibiotiques dans le domaine hospitalier, Anresis prend déjà en compte la répartition entre les groupes «Access», «Watch» et «Reserve»5). Avec seulement 48% de la consommation totale d’antibiotiques «Access» il y a en Suisse certainement encore un potentiel d’amélioration (fig. 2).

La figure 2a montre l’utilisation en DDD (Defined Daily Doses) pour 100 jours d’hospitalisation selon les classes d’antibiotiques.
La figure 2b montre les mêmes données selon les groupes OMS «Access», «Watch» et «Reserve».
OMS – manuel antibiotique
Dans le cadre de l’introduction récente des groupes AWaRe et la réévaluation par l’OMS des antibiotiques mentionnés dans la liste des médicaments essentiels, l’OMS a publié fin 2022 un manuel antibiotique20). Le manuel comprend des recommandations pour 20 indications fréquentes mondialement dans le domaine ambulatoire ainsi que pour 16 indications spécifiquement hospitalières.
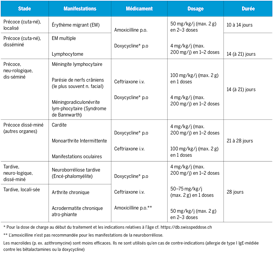
En principe on devrait privilégier les recommandations nationales, qui reflètent entre autres l’épidémiologie locale (recommandations et couverture vaccinales, résistances, etc.). Lorsque des recommandations ou directives nationales font défaut, le manuel peut servir de source d’information. Les recommandations pour chaque indication sont réparties comme illustré dans la figure 3, et correspondent donc au schéma «Disease, Drug, Dose, Delivery, Duration». Toutes les recommandations concernant les antibiotiques sont marquées selon le principe des feux de signalisation «Access» (vert), «Watch» (jaune) ou «Reserve» (rouge). Les informations concernant la possibilité d’un traitement symptomatique ou la nécessité d’un traitement antibiotique uniquement pour certains groupes de patients, symptômes ou signes cliniques sont mentionnées spécifiquement par rapport à l’indication. Le tableau 1 résume les recommandations OMS pour sept maladies infectieuses de l’enfant où la question de l’antibiothérapie peut se poser.
L’objectif du manuel antibiotique est de promouvoir mondialement une antibiothérapie de l’enfant et de l’adulte rationnelle et basée sur l’évidence.


Indication – est-ce que l’antibiotique est nécessaire?
Les guidelines, comme celles disponibles sur ssi.guidelines.ch, résument les recommandations basées sur l’évidence pour l’utilisation des antibiotiques et servent d’aide essentielle aux décisions du quotidien médical.
Pour certaines infections, fréquentes en pédiatrie, l’antibiothérapie n’est en général pas indiquée, ne diminuant ni plus rapidement les symptômes ni le risque de complications. En font partie la bronchiolite, la bronchite obstructive et la sinusite.
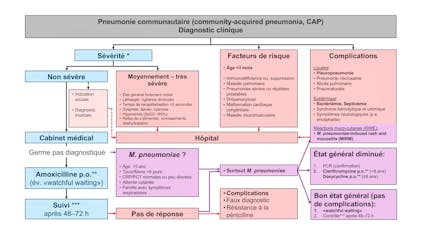
Pour d’autres infections des voies respiratoires aussi, une attitude «watchful waiting» est suffisante. C’est recommandé par exemple pour l’otite moyenne aiguë (surtout de l’enfant plus âgé sans facteurs de risque)12). Une métanalyse Cochrane de 2015 n’a pas constaté de différence concernant l’issue de critères importants entre les enfants traités d’emblée et ceux réévalués et traités lorsque les plaintes et les signes cliniques persistaient. En Suisse le traitement immédiat n’est recommandé qu’en cas d’otite moyenne aiguë bilatérale chez des enfants de moins de deux ans et d’otite moyenne aiguë perforée (cf. contribution de Jaboyedoff et al. dans la présente édition)21).
Il est plus compliqué de poser l’indication chez certains groupes de patients où le risque d’une évolution compliquée est plus élevé, comme par exemple les nourrissons en dessous de trois mois ou les enfants avec certaines maladies sous-jacentes (immunologiques, neurologiques, respiratoires). Cela implique que ces enfants sont souvent exclus des études relatives et des recommandations générales sur l’antibiothérapie, et reçoivent donc plus souvent des antibiotiques que les enfants sans facteurs de risque22).
Surtout dans le cadre ambulatoire il n’est pas toujours possible d’identifier, à l’aide d’analyses biologiques, les enfants qui profiteraient d’une antibiothérapie. Si on suspecte une infection qui peut être clairement confirmée ou écartée par des analyses relativement peu invasives, des échantillons devraient être prélevés avant le début du traitement. Des exemples sont les tests rapides lorsqu’on soupçonne une amygdalite à streptocoques du groupe A (recommandés dans des cas spécifiques, cf. contribution de Gualtieri et al. dans cette édition) ou des échantillons d’urine lors d’une possible infection urinaire23,24). On ne dispose de cultures microbiologiques qu’après un certain délai, elles servent alors à éventuellement adapter le traitement antibiotique (p.ex. lors d’infection des voies urinaires); elles sont néanmoins plus significatives si prélevées avant le début de l’antibiothérapie.
Pour de nombreuses infections pendant l’enfance et l’adolescence, des examens diagnostiques ne sont souvent pas ou difficilement réalisables, comme p.ex. l’examen du crachat chez les petits enfants ou pas utiles, comme p.ex. l’analyse de l’antigène pneumococcique dans l’urine lors de la pneumonie communautaire pendant l’enfance.
L’indication à la poursuite d’une antibiothérapie devrait être vérifiée lors de chaque consultation. Si on constate que le traitement n’était très vraisemblablement pas indiqué, il sera immédiatement interrompu.
Choix de l’antibiotique – que prescrire?
Lorsque l’indication à un traitement antibiotique est donnée, on choisira et on prescrira un antibiotique spécifique. Pour cela il faut connaître les modes d’action et donc la couverture antimicrobienne des différentes classes d’antibiotiques.
Sauf exception, dans le domaine ambulatoire le choix du traitement se fait empiriquement. Cela signifie que l’antibiotique est choisi d’après les connaissances générales de la microbiologie de l’infection en question, y compris des résistances locales, ainsi que des caractéristiques du patient. Un principe thérapeutique supplémentaire est le choix d’un antibiotique avec le spectre le plus étroit possible et un faible risque de sélection de bactéries résistantes. En règle générale on devrait donc prescrire un antibiotiques du groupe OMS «Access».
En Suisse les recommandations nationales sont publiées par exemple sur ssi.guidelines.ch et peuvent être consultées en lien avec les données sur les résistances dans infect.info25,26). infect.infoest également disponible gratuitement en tant qu’application pour smartphones IOS- ou Android-compatible.
Si dans un échantillon sont mis en évidence des bactéries spécifiques, n’étant pas une contamination mais très probablement responsables de la maladie de l’enfant, le traitement devrait être rapidement adapté à ce germe. Cela permet souvent d’éviter des effets collatéraux sur le microbiome, par exemple en remplaçant la co-amoxicilline par l’amoxicilline lors d’une infection urinaire par des E. coli sensibles à l’amoxicilline.
Une raison fréquente de s’écarter des recommandations empiriques et du traitement optimal et ciblé est une possible allergie aux antibiotiques. Dans la plupart des cas il s’agit de pénicillines, appelés en anglais «workhorse antibiotics». De vraies allergies du type I et type III aux pénicillines sont très rares, démontrables chez moins de 5% des enfants adressés pour une évaluation allergologique27). Souvent une anamnèse détaillée suffit pour exclure une telle allergie. Si ce n’est pas possible, un bilan allergologique est effectivement indiqué afin de faire bénéficier l’enfant d’un traitement antibiotique optimal lors d’éventuelles infections futures28).
Dosage – combien prescrire ?
Les données pour un dosage optimal dans le cadre ambulatoire sont très limitées pour la plupart des indications et antibiotiques. La prescription d’antibiotiques se fait donc en général suivant les indications du fabricant ou d’après les recommandations nationales. En Suisse la banque de données de SwissPedDose est une bonne source d’information pour les dosages usuels de la plupart des antibiotiques courants29).
Le dosage des antibiotiques oraux influence souvent directement l’acceptation du traitement. Ainsi en raison de leur caractéristiques pharmacologiques, certaines pénicillines devraient être prises plus souvent que d’autres, ce qui prétérite l’adhésion thérapeutique30). L’administration plus fréquente a manifestement des désavantages pour les enfants, qui doivent avaler plus souvent un médicament au goût désagréable et sont aussi entravés dans leur routine quotidienne31). L’administration moins fréquente de pénicillines, par exemple deux fois par jour avec un dosage plus élevé, devrait théoriquement être associée à des échecs thérapeutiques plus fréquents. Dans la pratique l’amoxicilline est pourtant souvent recommandée en deux doses quotidiennes et ne semble en général pas être associée à des complications plus fréquentes (équivalentes d’échecs thérapeutiques)32).
En outre les posologies des suspensions buvables varient sensiblement. Ainsi les suspensions d’amoxicilline en vente en Suisse contiennent 200 mg d’amoxicilline pour 4 ml, alors que les suspensions de co-amoxicilline (proportion amoxicilline à acide clavulanique de 7:1) couramment commercialisées contiennent 400 mg d’amoxicilline pour 5 ml. À dosage égal d’amoxicilline, pour atteindre par exemple 80 mg/kg en deux doses, cela représente pour en enfant de 10 kg une dose de 8 ml d’amoxicilline contre 5 ml de co-amoxicilline. Des volumes plus grands d’un médicament au mauvais goût sont plus difficiles à administrer31).
Galénique – comment administrer un antibiotique?
Dans le cadre ambulatoire les infections peuvent en général être traitées par voie orale. Les suspensions d’antibiotiques sont la forme galénique pour nourrissons et jeunes enfants la plus disponible en Suisse. En prescrivant un dosage quotidien élevé, il faut tenir compte du fait que chaque dose d’une suspension d’antibiotique peut représenter un volume considérable, surtout lors d’un schéma à deux doses par jour.
Les comprimés dispersibles sont moins utilisés en Suisse, alors qu’ils ont certains avantages et qu’on peut les obtenir pour l’amoxicilline et la co-amoxicilline. Ils ne doivent par exemple pas être conservés au frais comme c’est le cas pour la suspension33). De plus les comprimés dispersibles peuvent être administrés d’après des tranches de poids, ce qui réduit sensiblement le risque d’erreur lors de l’administration par les parents34).
Un traitement par voie intraveineuse est également possible en ambulatoire mais devrait être effectué dans le cadre d’une collaboration établie avec un hôpital, idéalement un programme pOPAT (pediatric Outpatient Parenteral Antibiotic Therapy)35). Le traitement pOPAT est pour ainsi dire toujours initié au service (d’urgence) hospitalier et poursuivi en collaboration avec le/la pédiatre et un service de soins pédiatriques à domicile. Des exemples d’indication pour une pOPAT sont la neuroborréliose ou le traitement intraveineux prolongé d’un abcès cérébral.
Durée – combien de temps traiter un enfant?
La durée de l’antibiothérapie représente d’après les connaissances actuelles, de pair avec la pose d’une indication stricte, le plus grand potentiel d’optimisation36). Historiquement des traitements plus longs étaient recommandés aussi pour le traitement oral ambulatoire. Par le passé on suggérait aussi qu’en s’écartant de la durée prescrite, le traitement d’infections ultérieures serait moins efficace36). À ce jour rien n’indique que des traitements plus courts augmentent les résistances aux antibiotiques.
Des études récentes sur des indications fréquentes montrent qu’une antibiothérapie de plus courte durée est tout aussi efficace qu’un traitement plus long. Globalement un traitement antibiotique devrait être aussi bref que possible, en cas de doute avec un contrôle clinique à court terme37). Les autres contributions dans cette édition de Paediatrica l’illustrent à l’aide d’exemples concrets comme l’otite moyenne aiguë, la pharyngite, la pneumonie et la borréliose. Une antibiothérapie qui s’avère par la suite non indiquée, peut et doit donc être interrompue.
Conclusion – «Si ça sert à rien, c’est pas non plus nécessaire»
Il faut espérer que les antibiothérapies «au cas où» appartiennent au passé. On peut utiliser la structure Disease (indication), Drug (choix de l’antibiotique), Dose (dosage), Delivery (galénique/mode d’administration) et Duration (durée du traitement) pour favoriser une antibiothérapie rationnelle en pédiatrie. Si des recommandations nationales existent, on devrait les suivre autant que possible. Si ce n’est pas le cas, on peut consulter le nouveau manuel OMS qui propose des recommandations détaillées sur tous les aspects concernant l’évaluation, le diagnostic et le traitement. En procédant de manière structurée on peut réduire l’exposition des enfants et adolescent-e-s aux antibiotiques lorsqu’ils ne sont pas indiqués, et garantir en même temps que les patient-e-s avec une indication claire bénéficient d’un traitement optimal.
Références
- Sturkenboom MCJM, Verhamme KMC, Nicolosi A, Murray ML, Neubert A, Caudri D, et al. Drug use in children: cohort study in three European countries. BMJ. 2008;337:a2245.
- Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet. 2022;399(10325):629-55.
- Jackson C, Hsia Y, Bielicki JA, Ellis S, Stephens P, Wong ICK, et al. Estimating global trends in total and childhood antibiotic consumption, 2011-2015. BMJ Global Health. 2019;4(1):e001241.
- Cars O, Mölstad S, Melander A. Variation in antibiotic use in the European Union. The Lancet. 2001;357(9271):1851-3.
- Anresis – Institut für Infektionskrankheiten. Humanmedizin – Antibiotikakonsum [Available from: https://www.anresis.ch/de/antibiotikaverbrauch/humanmedizin-ambulant/.
- Holstiege J, Garbe E. Systemic antibiotic use among children and adolescents in Germany: a population-based study. Eur J Pediatr. 2013;172(6):787-95.
- Hersh AL, Shapiro DJ, Pavia AT, Shah SS. Antibiotic Prescribing in Ambulatory Pediatrics in the United States. Pediatrics. 2011;128(6):1053-61.
- Fleming-Dutra KE, Hersh AL, Shapiro DJ, Bartoces M, Enns EA, File TM, Jr, et al. Prevalence of Inappropriate Antibiotic Prescriptions Among US Ambulatory Care Visits, 2010-2011. JAMA. 2016;315(17):1864-73.
- Cushen R, Francis NA. Antibiotic use and serious complications following acute otitis media and acute sinusitis: a retrospective cohort study. British Journal of General Practice. 2020;70(693):e255-e63.
- Djabali EJ, Smolinski NE, JA-B, Pomputius A, Antonelli PJ, Winterstein AG. Antibiotic Treatment for Pediatric Acute Otitis Media and the Prevention of Serious Complications: A Meta-analysis. Pediatrics. 2022;149(1 Meeting Abstracts February 2022):143-.
- Spinks A, Glasziou PP, Del Mar CB. Antibiotics for treatment of sore throat in children and adults. Cochrane Database Syst Rev. 2021;12:CD000023.
- Venekamp RP, Sanders SL, Glasziou PP, Del Mar CB, Rovers MM. Antibiotics for acute otitis media in children. Cochrane Database Syst Rev. 2015(6):CD000219.
- Ibia EO, Schwartz RH, Wiedermann BL. Antibiotic Rashes in Children: A Survey in a Private Practice Setting. Archives of Dermatology. 2000;136(7):849-54.
- Kuehn J, Ismael Z, Long PF, Barker CI, Sharland M. Reported rates of diarrhea following oral penicillin therapy in pediatric clinical trials. J Pediatr Pharmacol Ther. 2015;20(2):90-104.
- Duong QA, Pittet LF, Curtis N, Zimmermann P. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. Journal of Infection. 2022;85(3):213-300.
- Lynn DJ, Benson SC, Lynn MA, Pulendran B. Modulation of immune responses to vaccination by the microbiota: implications and potential mechanisms. Nat Rev Immunol. 2022;22(1):33-46.
- Sharland M, Gandra S, Huttner B, Moja L, Pulcini C, Zeng M, et al. Encouraging AWaRe-ness and discouraging inappropriate antibiotic use-the new 2019 Essential Medicines List becomes a global antibiotic stewardship tool. Lancet Infect Dis. 2019;19(12):1278-80.
- Sulis G, Sayood S, Katukoori S, Bollam N, George I, Yaeger LH, et al. Exposure to World Health Organization’s AWaRe antibiotics and isolation of multidrug resistant bacteria: a systematic review and meta-analysis. Clin Microbiol Infect. 2022;28(9):1193-202.
- Hsia Y, Sharland M, Jackson C, Wong ICK, Magrini N, Bielicki JA. Consumption of oral antibiotic formulations for young children according to the WHO Access, Watch, Reserve (AWaRe) antibiotic groups: an analysis of sales data from 70 middle-income and high-income countries. The Lancet Infectious Diseases. 2019;19(1):67-75.
- Sharland M, Cappello B, Ombajo LA, Bazira J, Chitatanga R, Chuki P, et al. The WHO AWaRe Antibiotic Book: providing guidance on optimal use and informing policy. Lancet Infect Dis. 2022;22(11):1528-30.
- Schweizerische Gesellschaft für Infektiologie. Akute Otitis media (AOM) 2022 [updated 12 Aug 2022. Available from: https://ssi.guidelines.ch/guideline/2406/de.
- Grammatico-Guillon L, Shea K, Jafarzadeh SR, Camelo I, Maakaroun-Vermesse Z, Figueira M, et al. Antibiotic Prescribing in Outpatient Children: A Cohort From a Clinical Data Warehouse. Clin Pediatr (Phila). 2019;58(6):681-90.
- Schweizerische Gesellschaft für Infektiologie. Pharyngitis 2022 [updated 24 Aug 2022. Available from: https://ssi.guidelines.ch/guideline/2408/de.
- Schweizerische Gesellschaft für Infektiologie. Harnwegsinfektionen bei Kindern und Jugendlichen 2022 [updated 4 Feb 2022. Available from: https://ssi.guidelines.ch/guideline/4005/de.
- INFECT. INterface For Empirical antimicrobial ChemoTherapy 2022 [Available from: https://infect.info/.
- Schweizerische Gesellschaft für Infektiologie. Schweizerische Gesellschaft für Infektiologie – GUIDELINES 2022 [Available from: https://ssi.guidelines.ch/.
- Kuniyoshi Y, Tsujimoto Y, Banno M, Taito S, Ariie T, Kubota T, et al. Beta-lactam allergy and drug challenge test in children: a systematic review and meta-analysis. Pediatric Research. 2022.
- Vyles D, Antoon JW, Norton A, Stone CA, Trubiano J, Radowicz A, et al. Children with reported penicillin allergy: Public health impact and safety of delabeling. Annals of Allergy, Asthma & Immunology. 2020;124(6):558-65.
- SwissPedDose. Nationale Datenbank zur Dosierung von Arzneimitteln bei Kindern (SwissPedDose) 2022 [updated 25 Oct 2022. Available from: https://db.swisspeddose.ch/de/search/.
- Falagas ME, Karagiannis AKA, Nakouti T, Tansarli GS. Compliance with Once-Daily versus Twice or Thrice-Daily Administration of Antibiotic Regimens: A Meta-Analysis of Randomized Controlled Trials. PLOS ONE. 2015;10(1):e0116207.
- Baguley D, Lim E, Bevan A, Pallet A, Faust SN. Prescribing for children – taste and palatability affect adherence to antibiotics: a review. Archives of Disease in Childhood. 2012;97(3):293-7.
- Vilas-Boas A-L, Fontoura M-SH, Xavier-Souza G, Araújo-Neto CA, Andrade SC, Brim RV, et al. Comparison of oral amoxicillin given thrice or twice daily to children between 2 and 59 months old with non-severe pneumonia: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 2014;69(7):1954-9.
- Mack I, Sharland M, Brussee JM, Rehm S, Rentsch K, Bielicki J. Insufficient Stability of Clavulanic Acid in Widely Used Child-Appropriate Formulations. Antibiotics. 2021;10(2):225.
- Bielicki JA, Barker CI, Saxena S, Wong IC, Long PF, Sharland M. Not too little, not too much: problems of selecting oral antibiotic dose for children. Bmj. 2015;351:h5447.
- Patel S, Abrahamson E, Goldring S, Green H, Wickens H, Laundy M. Good practice recommendations for paediatric outpatient parenteral antibiotic therapy (p-OPAT) in the UK: a consensus statement. J Antimicrob Chemother. 2015;70(2):360-73.
- Llewelyn MJ, Fitzpatrick JM, Darwin E, SarahTonkin-Crine, Gorton C, Paul J, et al. The antibiotic course has had its day. BMJ. 2017;358:j3418.
- McMullan BJ, Andresen D, Blyth CC, Avent ML, Bowen AC, Britton PN, et al. Antibiotic duration and timing of the switch from intravenous to oral route for bacterial infections in children: systematic review and guidelines. Lancet Infect Dis. 2016;16(8):e139-52.